题目内容
5.今有A、B、C、D四种元素,其中A元素是1826年一位法国青年科学家发现的.他在研究海水制盐时,往剩余的副产物苦卤中通入氯气后发现溶液颜色变深,若进一步提取,可得一种红棕色液体,有刺鼻的气味.B、C、D的原子核外电子层均不超过3个.D原子核内的质子数正好等于C原子核内质子数的2倍,而它们最外电子层上的电子数恰好相等.D原子的最内电子层上电子数则是B原子核外电子总数的2倍.则(1)四种元素分别为:ABr,BH,CO,DS.(写出元素符号)
(2)由A元素的单质与C、D两种元素的化合物的水溶液反应生成两种酸的化学方是SO2+Br2+2H2O═H2SO4+2HBr.
分析 A、B、C、D四种元素,A元素是一种红棕色液体,有刺鼻的臭味,则A单质是溴,A为Br元素;B、C、D的原子电子层排布均不超过3个电子层,D原子核内的质子数正好等于C原子核内质子数的2倍,而它们最外电子层上的电子数恰好相等,说明C、D是同一主族元素,则C是O元素、D是S元素;D原子的最内电子层上电子数是B原子核外电子数的2倍,则B是H元素,即A是Br元素、B是H元素、C是O元素、D是S元素,据此结合物质性质解答.
解答 解:(1)通过以上分析知,A是Br元素、B是H元素、C是O元素、D是S元素,
故答案为:Br;H;O;S;
(2)A是Br、C是O、D是S,A的单质为Br2,C、D两种元素的化合物能够与溴单质反应,则该化合物为SO2,溴单质能够与二氧化硫反应生成硫酸和HBr,反应的化学方程式为:SO2+Br2+2H2O═H2SO4+2HBr,
故答案为:.
点评 本题考查原子结构与元素周期律的应用,题目难度中等,推断元素为解答结构,注意熟练掌握原子结构与元素周期表、元素周期律的关系,试题培养了学生的分析能力及逻辑推理能力.

练习册系列答案
相关题目
15.下列有关说法中正确的是( )
| A. | 某温度时的混合溶液中c(H+)=$\sqrt{{K}_{W}}$mol•L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数) | |
| B. | 由水电离出的c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.向含有Cl-、CrO42-且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO42-先产生沉淀 | |
| D. | 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-) |
16. 已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图所示.下列说法正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图所示.下列说法正确的是( )
 已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图所示.下列说法正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图所示.下列说法正确的是( )| A. | 反应过程中的氧化产物均为Na2HSO4 | |
| B. | a点时剩余NaHSO3的物质的量为1.0 mol | |
| C. | 0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-+3OH-=3SO43-+I-+3H2O | |
| D. | 当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为1.1mol |
13. 把一块镁铝合金投入到1mol/LHCl溶液里,待合金完全溶解后,往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化关系如图所示.下列说法中不正确的是( )
把一块镁铝合金投入到1mol/LHCl溶液里,待合金完全溶解后,往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化关系如图所示.下列说法中不正确的是( )
 把一块镁铝合金投入到1mol/LHCl溶液里,待合金完全溶解后,往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化关系如图所示.下列说法中不正确的是( )
把一块镁铝合金投入到1mol/LHCl溶液里,待合金完全溶解后,往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化关系如图所示.下列说法中不正确的是( )| A. | a的取值范围为0≤a<50 | |
| B. | 当a=30时,$\frac{n(Mg)}{n(Al)}$=1 | |
| C. | 图中0~a段,与NaOH发生反应的微粒是H+ | |
| D. | 当v(NaOH)=90mL时,溶液中的溶质为NaAlO2 |
10.已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O$\stackrel{高温}{?}$CH3COO-+H3O+ K1=1.75×10-5 mol•L-1,
CH3COO-+H2O$\stackrel{高温}{?}$CH3COOH+OH- K2=5.71×10-10mol•L-1
现将50mL 0.2mol•L-1醋酸与50mL 0.2mol•L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是( )
CH3COOH+H2O$\stackrel{高温}{?}$CH3COO-+H3O+ K1=1.75×10-5 mol•L-1,
CH3COO-+H2O$\stackrel{高温}{?}$CH3COOH+OH- K2=5.71×10-10mol•L-1
现将50mL 0.2mol•L-1醋酸与50mL 0.2mol•L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是( )
| A. | 溶液甲的pH>7 | |
| B. | 对溶液甲进行微热,K1、K2同时增大 | |
| C. | 溶液甲中,c(Na+)+c(H+)=c(CH3COO-) | |
| D. | 若在溶液甲中加入5 mL 0.1 mol•L-1的盐酸,则溶液中醋酸的K1会变大 |
17.下列实验中所选用的仪器合理的是( )
| A. | 用100mL量筒量取5.2mL的稀硫酸 | |
| B. | 用500mL容量瓶配制480mL 0.2mol/L的NaOH溶液 | |
| C. | 用托盘天平称量11.75克NaCl晶体 | |
| D. | 用分液漏斗进行固体和液体的分离 |
14.下列指定反应的离子方程式正确的是( )
| A. | 用盐酸除铁锈:Fe2O3•xH2O+6H+═2Fe3++(3+x)H2O | |
| B. | Mg(HCO3)2溶液与足量的 NaOH 溶液反应:Mg2++HCO3-+OH-═MgCO3↓+H2O | |
| C. | 强碱性溶液中次氯酸钠溶液与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ | |
| D. | 用NaOH 溶液吸收 NO2:2NO2+2OH-═2NO3-+H2O |
15.下列转化不能通过一步反应实现的是( )
| A. | CuO→Cu2O | B. | H2SiO3→SiO2 | C. | Cu→Cu2(OH)2CO3 | D. | Cu→Cu(OH)2 |
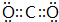 ,BA2分子中化学键属于共价键.
,BA2分子中化学键属于共价键.