题目内容
下列说法正确的是( )
| A、若把H2S分子写成H3S分子,违背了共价键的饱和性 |
| B、s轨道和p轨道重叠可以形成π键 |
| C、所有共价键都有方向性 |
| D、两个原子之间形成共价键时,可形成多个σ键 |
考点:共价键的形成及共价键的主要类型
专题:化学键与晶体结构
分析:A.S最外层有6个电子,只能结合2个H;
B.s轨道和p轨道只能头碰头重叠;
C.s-s共价键没有方向性;
D.两个原子之间形成共价键时,只能存在1个σ键.
B.s轨道和p轨道只能头碰头重叠;
C.s-s共价键没有方向性;
D.两个原子之间形成共价键时,只能存在1个σ键.
解答:
解:A.S最外层有6个电子,只能结合2个H,形成H2S分子,若写成H3S分子,违背了共价键的饱和性,故A正确;
B.s轨道和p轨道只能头碰头重叠,形成σ键,而未参加杂化的p轨道可形成π键,故B错误;
C.s-s共价键没有方向性,可以任意方向重叠,故C错误;
D.两个原子之间形成共价键时,形成单键、双键或三键时,只能存在1个σ键,故D错误;
故选A.
B.s轨道和p轨道只能头碰头重叠,形成σ键,而未参加杂化的p轨道可形成π键,故B错误;
C.s-s共价键没有方向性,可以任意方向重叠,故C错误;
D.两个原子之间形成共价键时,形成单键、双键或三键时,只能存在1个σ键,故D错误;
故选A.
点评:本题考查共价键的形成及类型,为高频考点,把握共价键的方向性和饱和性为解答的关键,注意π键的形成,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
近期,北京,珠三角近相继出现了PM2.5大范围超标的情况.科学家用PM2.5表示每立方米空气中这种颗粒的含量,这个值越高,就代表空气污染越严重,对人身体的健康危害越大.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物,汽车尾气、冬天供暖锅炉烟气排放、工厂的烟气排放、低温无风天气的持续导致PM2.5持续走高.下列有关说法中正确的是:( )
(1)大量关闭化工生产企业
(2)PM2.5专用口罩使用了活性炭,是利用了活性炭的吸附性
(3)上述颗粒物可产生丁达尔效应
(4)杜绝能源的开采
(5)燃放烟花爆竹会产生PM2.5;
(6)PM2.5是造成灰霾天气的“元凶”之一;
(7)PM2.5的颗粒大小与分子大小差不多.
(1)大量关闭化工生产企业
(2)PM2.5专用口罩使用了活性炭,是利用了活性炭的吸附性
(3)上述颗粒物可产生丁达尔效应
(4)杜绝能源的开采
(5)燃放烟花爆竹会产生PM2.5;
(6)PM2.5是造成灰霾天气的“元凶”之一;
(7)PM2.5的颗粒大小与分子大小差不多.
| A、(1)(2)(3)(7) |
| B、(2)(3)(5)(7) |
| C、(2)(5)(6) |
| D、(2)(3)(4)(5)(7) |
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可以通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是( )
| ||
| A、KClO3在反应中失去电子 |
| B、ClO2是氧化产物 |
| C、H2C2O4在反应中被还原 |
| D、此反应中每生成1 mol ClO2转移的电子为1 mol |
在MgCl2、KCl、K2SO的混合溶液中,若K+为0.8mol,Cl-为1.3mol,Mg2+为0.5mol,则SO42-的物质的量为( )
| A、0.1mol |
| B、0.5mol |
| C、0.15mol |
| D、0.25mol |
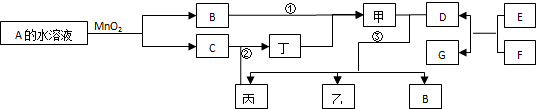
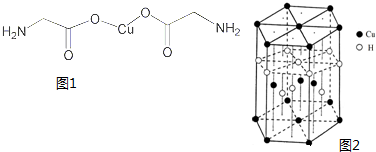 (1)亚铜离子(Cu+)基态时的价电子排布式表示为
(1)亚铜离子(Cu+)基态时的价电子排布式表示为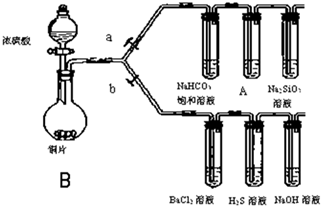 根据要求完成下列各小题实验目的.(如图a、b为弹簧夹,加热及固定装置已略去)
根据要求完成下列各小题实验目的.(如图a、b为弹簧夹,加热及固定装置已略去)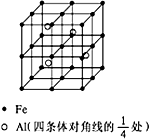 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.