题目内容
 (1)亚铜离子(Cu+)基态时的价电子排布式表示为
(1)亚铜离子(Cu+)基态时的价电子排布式表示为(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为
(3)Cu晶体的堆积方式是
A.[Cu (NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Cu(NH3)4]2+中Cu2+给出孤对电子,NH3提供空轨道
C.[Cu (NH3)4]SO4组成元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为正四面体
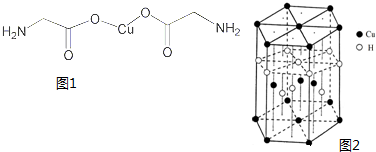
(4)氨基乙酸铜的分子结构如图1,碳原子的杂化方式为
(5)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图2所示.则该化合物的化学式为
考点:晶胞的计算,原子核外电子排布,元素电离能、电负性的含义及应用,配合物的成键情况,原子轨道杂化方式及杂化类型判断
专题:
分析:(1)根据构造原理写出其核外电子排布式;
(2)同一周期中元素的第一电离能随着原子序数的增大而呈增大的趋势,但第VA族元素大于其相邻元素;
(3)Cu晶体的堆积方式是面心立方最密堆积,配位数为12;根据的[Cu(NH3)4]SO4结构判断选项;
(4)根据碳原子的成键情况要以判断碳原子的杂化方式;
(5)利用均摊法确定其化学式.
(2)同一周期中元素的第一电离能随着原子序数的增大而呈增大的趋势,但第VA族元素大于其相邻元素;
(3)Cu晶体的堆积方式是面心立方最密堆积,配位数为12;根据的[Cu(NH3)4]SO4结构判断选项;
(4)根据碳原子的成键情况要以判断碳原子的杂化方式;
(5)利用均摊法确定其化学式.
解答:
解:(1)铜是29号元素,铜原子失去一个电子变成亚铜离子,所以亚铜离子核外有28个电子,基态铜离子(Cu+)的价电子排布式为:3d10,故答案为:3d10;
(2)As、Se、Br属于同一周期且原子序数逐渐增大,这三种元素依次属于第IVA族、第VA族、第VIA族,第VA族元素大于其相邻元素的第一电离能,所以3种元素的第一电离能从大到小顺序为Br>As>Se,故答案为:Br>As>Se;
(3)Cu晶体的堆积方式是面心立方最密堆积,配位数为12;
A、N与H原子形成极性共价键,[Cu(NH3)4]2+与SO42-形成离子键,Cu2+与NH3形成配位键,故A正确;
B、氨气分子的键角小于水分子的键角,故B错误;
C、金属的第一电离能比非金属元素的第一电离能大,故C错误;
D、SO42-与PO43-原子个数相等,价电子数相等,互为等电子体,空间构型均为正四面体,故D正确;
故答案为:面心立方最密堆积;12;AD;
(4)氨基乙酸铜的分子中一种碳有碳氧双键,碳的杂化方式为sp2杂化,另一种碳周围都是单键,碳的杂化方式为sp3杂化;
故答案为:sp3、sp2;
(5)该晶胞中,Cu原子在晶胞体内,故Cu原子个数=4,Cl原子在晶胞顶点和面心,故Cl原子个数=8×
+6×
=4,所以其化学式为CuCl.
故答案为:CuCl.
(2)As、Se、Br属于同一周期且原子序数逐渐增大,这三种元素依次属于第IVA族、第VA族、第VIA族,第VA族元素大于其相邻元素的第一电离能,所以3种元素的第一电离能从大到小顺序为Br>As>Se,故答案为:Br>As>Se;
(3)Cu晶体的堆积方式是面心立方最密堆积,配位数为12;
A、N与H原子形成极性共价键,[Cu(NH3)4]2+与SO42-形成离子键,Cu2+与NH3形成配位键,故A正确;
B、氨气分子的键角小于水分子的键角,故B错误;
C、金属的第一电离能比非金属元素的第一电离能大,故C错误;
D、SO42-与PO43-原子个数相等,价电子数相等,互为等电子体,空间构型均为正四面体,故D正确;
故答案为:面心立方最密堆积;12;AD;
(4)氨基乙酸铜的分子中一种碳有碳氧双键,碳的杂化方式为sp2杂化,另一种碳周围都是单键,碳的杂化方式为sp3杂化;
故答案为:sp3、sp2;
(5)该晶胞中,Cu原子在晶胞体内,故Cu原子个数=4,Cl原子在晶胞顶点和面心,故Cl原子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:CuCl.
点评:本题考查了晶胞的计算、元素周期律、原子杂化等知识点,这些都是学习重点也是学习难点,同时考查学生的空间想象能力、分析问题能力、数学分析逻辑能力等,难度较大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
对于可逆反应M+N?Q达到平衡时,下列说法正确的是( )
| A、M、N、Q三种物质的浓度一定相等 |
| B、M、N全部变成了Q |
| C、反应物和生成物的浓度都保持不变 |
| D、反应已经停止 |
钢铁制品表面镀铝既美观又能防腐.镀铝时选用的阳极材料是( )
| A、Zn |
| B、Fe |
| C、Al |
| D、AlCl3 |
定容容器A与定压容器B的体积开始时相同,内皆装有同质量、同物质的量之比的SO2与O2混合气体,经一定时间在相同温度下达到平衡.有关叙述正确的是( )
| A、A、B中SO2的转化率相同 |
| B、B中的反应速率比A中快 |
| C、A中SO2的转化率比B中高 |
| D、若A、B中皆再加入同量的氩气,平衡不移动 |
能源可划分为一级能源和二级能源.自然界中以现成形式提供的能源称为一级能源,需依靠其它能源的能量间接制取的能源成为二级能源.下列能源是一级能源的是( )
| A、电能 | B、太阳能 |
| C、氢气 | D、水煤气 |
在周期表主族元素中,X元素位于第二周期,且分别与Y、Z、W三种元素相邻,X、Y的原子序数之和等于Z的原子序数;这四种元素原子的最外层电子数之和为20.下列判断正确的是( )
| A、原子序数:Z>W>X>Y |
| B、X、Y、Z、W形成的单质最多有6种 |
| C、X元素最高价氧化物对应水化物的化学式为:HXO3 |
| D、四种元素的气态氢化物中,W的气态氢化物最稳定 |
下列说法正确的是( )
| A、若把H2S分子写成H3S分子,违背了共价键的饱和性 |
| B、s轨道和p轨道重叠可以形成π键 |
| C、所有共价键都有方向性 |
| D、两个原子之间形成共价键时,可形成多个σ键 |
下列关于制取蒸馏水的实验装置与操作的说法中,不正确的是( )
| A、温度计的水银球应插入蒸馏烧瓶中的自来水中 |
| B、冷凝管中的水流方向是从下口进入,上口排出 |
| C、实验中需要在蒸馏烧瓶中加入几粒碎瓷片,防止出现暴沸现象 |
| D、蒸馏烧瓶必须垫石棉网 |