题目内容
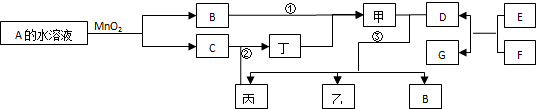
已知化合物A与B、丙与丁的元素组成相同,且四种物质中都含有同一种元素.A与B在常温下均呈液态.D与F都为固体单质,且D、F与甲的浓溶液在常温下钝化,都无明显现象,加热时有大量气体产生.(相关转化部分反应条件和生成物未标出).
(1)B的电子式 ,E与F的反应是 (填反应名称),写出在工业生产中此反应的两个用途 、 .
(2)以D、F为电极,NaOH溶液为电解质溶液可以组成原电池,原电池负极的电极反应为: .
(3)若反应①除生成甲外,还生成丙,☆写出过量D与甲稀溶液反应的离子方程式: .
( 4)若B与丁反应生成甲是化合反应,工业上利用该反应制备甲,请写出下列方程式:
②
③ .

(1)B的电子式
(2)以D、F为电极,NaOH溶液为电解质溶液可以组成原电池,原电池负极的电极反应为:
(3)若反应①除生成甲外,还生成丙,☆写出过量D与甲稀溶液反应的离子方程式:
( 4)若B与丁反应生成甲是化合反应,工业上利用该反应制备甲,请写出下列方程式:
②
③
考点:无机物的推断
专题:推断题
分析:A与B在常温下均呈液态,由转化关系可知,A为H2O2,B为H2O,C为O2,D与F都为常见金属单质,且D、F与甲的浓溶液在常温作用都无明显现象,可认为发生钝化反应,且F可置换生成D,则F为Al,D为Fe,为铝热反应,A与丙可以化合生成甲,可知甲为硫酸,丙为SO2,丁为SO3,乙为Fe2(SO4)3,X为FeSO4,结合对应物质的性质以及题目要求解答该题.
解答:
解:A与B在常温下均呈液态,由转化关系可知,A为H2O2,B为H2O,C为O2,D与F都为常见金属单质,且D、F与甲的浓溶液在常温作用都无明显现象,可认为发生钝化反应,且F可置换生成D,则F为Al,D为Fe,为铝热反应,A与丙可以化合生成甲,可知甲为硫酸,丙为SO2,丁为SO3,乙为Fe2(SO4)3,X为FeSO4,
(1)B为H2O,电子式为 ,E与F的反应是铝热反应,可用于焊接铁轨或冶炼金属,
,E与F的反应是铝热反应,可用于焊接铁轨或冶炼金属,
故答案为: ;铝热反应;焊接铁轨;冶炼金属;
;铝热反应;焊接铁轨;冶炼金属;
(2)以D、F为电极,NaOH溶液为电解质溶液可以组成原电池,电池反应为4Al+3O2+4NaOH=4NaAlO2+2H2O,则Al为负极,电极反应为2Al-6e-+4OH-=2AlO2-+2H2O,
故答案为:2Al-6e-+4OH-=2AlO2-+2H2O;
(3)Fe与过量硝酸反应生成硝酸亚铁和一氧化氮气体,反应的离子方程式为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,
故答案为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;
(4)②为二氧化硫和氧气的反应,方程式为2SO2+O2
2SO3;③为Fe与浓硫酸的反应,反应方程式为:2Fe+6H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O.
故答案为:2SO2+O2
2SO3;2Fe+6H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O.
(1)B为H2O,电子式为
 ,E与F的反应是铝热反应,可用于焊接铁轨或冶炼金属,
,E与F的反应是铝热反应,可用于焊接铁轨或冶炼金属,故答案为:
 ;铝热反应;焊接铁轨;冶炼金属;
;铝热反应;焊接铁轨;冶炼金属;(2)以D、F为电极,NaOH溶液为电解质溶液可以组成原电池,电池反应为4Al+3O2+4NaOH=4NaAlO2+2H2O,则Al为负极,电极反应为2Al-6e-+4OH-=2AlO2-+2H2O,
故答案为:2Al-6e-+4OH-=2AlO2-+2H2O;
(3)Fe与过量硝酸反应生成硝酸亚铁和一氧化氮气体,反应的离子方程式为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,
故答案为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;
(4)②为二氧化硫和氧气的反应,方程式为2SO2+O2
| ||
| △ |
| ||
故答案为:2SO2+O2
| ||
| △ |
| ||
点评:本题考查无机物的推断,侧重于学生的分析能力和计算能力的考查,为高考常见题型,题目难度中等,注意把握物质的性质、用途等特征为解答该题的关键.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA |
| B、14g乙烯、丙烯的混合气体含有C-H数为2NA |
| C、标准状况下,4.48L重水(D2O)中含有的中子数为2NA |
| D、向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA |
对于可逆反应M+N?Q达到平衡时,下列说法正确的是( )
| A、M、N、Q三种物质的浓度一定相等 |
| B、M、N全部变成了Q |
| C、反应物和生成物的浓度都保持不变 |
| D、反应已经停止 |
铜和镁的合金4.6g完全溶于浓硝酸,若反应后硝酸被还原只产生 2.24L的 NO2气体和1.12L的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为( )
| A、9.02g |
| B、8.51g |
| C、8.00g |
| D、7.04g |
钢铁制品表面镀铝既美观又能防腐.镀铝时选用的阳极材料是( )
| A、Zn |
| B、Fe |
| C、Al |
| D、AlCl3 |
定容容器A与定压容器B的体积开始时相同,内皆装有同质量、同物质的量之比的SO2与O2混合气体,经一定时间在相同温度下达到平衡.有关叙述正确的是( )
| A、A、B中SO2的转化率相同 |
| B、B中的反应速率比A中快 |
| C、A中SO2的转化率比B中高 |
| D、若A、B中皆再加入同量的氩气,平衡不移动 |
下列说法正确的是( )
| A、若把H2S分子写成H3S分子,违背了共价键的饱和性 |
| B、s轨道和p轨道重叠可以形成π键 |
| C、所有共价键都有方向性 |
| D、两个原子之间形成共价键时,可形成多个σ键 |

 某金属A及其化合物之间有如下转化关系.
某金属A及其化合物之间有如下转化关系.