题目内容
5.A是衡量一个国家石油化工工业发展水平的标志,是非常重要的化工原料.G是具有香味的无色液体,有机合成重要的中间体,在有机合成上应用广泛.已知:
(1)
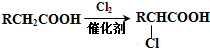
(2)RCH2Cl$\underset{\stackrel{①NaCN,O{H}^{-}}{→}}{②{H}_{2}O,{H}^{+}}$RCH2COOH
(3)
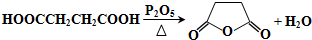
下列是关于A的性质及合成G的路线(部分条件及产物已略去).
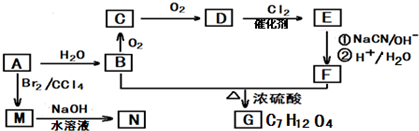
请回答(1)~(3)题:
(1)E中所含官能团的名称:氯原子、羧基.
(2)写出下列化学方程式:
M→N:BrCH2CH2Br+2NaOH$→_{△}^{H_{2}O}$OHCH2CH2OH+2NaBr.
B+F→G:2CH3CH2OH+HOOCCH2COOH$?_{△}^{浓H_{2}SO_{4}}$CH3CH2OOCCH2COOCH2CH3+2H2O.
F与N反应生成高分子化合物:nHOOCCH2COOH+nOHCH2CH2OH$→_{△}^{催化剂}$
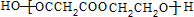 +(2n-1)H2O.
+(2n-1)H2O.(3)写出与G官能团完全相同、核磁共振氢谱有2组峰的任意一种同分异构体的结构简式:CH3OOCC(CH3)2COOCH3.
(4)由上述M与必要的试剂可以合成一种农药的中间体马来酸酐.合成路线如下:
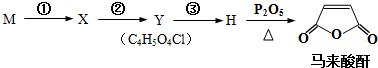
写出Y的结构简式HOOCCHClCH2COOH.
写出反应②③所加试剂、反应条件,指出反应类型.
| 序号 | 所加试剂及条件 | 反应类型 |
| ② | ||
| ③ | , |
分析 A是衡量一个国家石油化工发展水平的标志,则A为CH2=CH2,A与水反应生成B为CH3CH2OH,B氧化生成C为CH3CHO,C氧化生成D为CH3COOH,结合信息(1)可知E为ClCH2COOH,结合信息(2)可知,F为HOOCCH2COOH,B与F发生酯化反应生成G为CH3CH2OOCCH2COOCH2CH3,A与溴发生加成反应生成M为BrCH2CH2Br,M发生水解反应生成N为OHCH2CH2OH,以此解答(1)~(3);
(4)由上述M与必要的试剂可以合成一种农药的中间体马来酸酐,合成路线可知,M为BrCH2CH2Br,M发生信息(2)的反应生成X为HOOCCH2CH2COOH,X发生信息(1)的反应生成Y为HOOCCHClCH2COOH,③为卤代烃的消去反应,以此来解答.
解答 解:A是衡量一个国家石油化工发展水平的标志,则A为CH2=CH2,A与水反应生成B为CH3CH2OH,B氧化生成C为CH3CHO,C氧化生成D为CH3COOH,结合信息(1)可知E为ClCH2COOH,结合信息(2)可知,F为HOOCCH2COOH,B与F发生酯化反应生成G为CH3CH2OOCCH2COOCH2CH3,A与溴发生加成反应生成M为BrCH2CH2Br,M发生水解反应生成N为OHCH2CH2OH,
(1)E为ClCH2COOH,官能团为氯原子、羧基,故答案为:氯原子;羧基;
(2)M→N的反应为BrCH2CH2Br+2NaOH$→_{△}^{H_{2}O}$OHCH2CH2OH+2NaBr,
B+F→G的反应为2CH3CH2OH+HOOCCH2COOH$?_{△}^{浓H_{2}SO_{4}}$CH3CH2OOCCH2COOCH2CH3+2H2O,
F与N反应生成高分子化合物的反应为nHOOCCH2COOH+nOHCH2CH2OH$→_{△}^{催化剂}$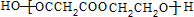 +(2n-1)H2O,
+(2n-1)H2O,
故答案为:BrCH2CH2Br+2NaOH$→_{△}^{H_{2}O}$OHCH2CH2OH+2NaBr;2CH3CH2OH+HOOCCH2COOH$?_{△}^{浓H_{2}SO_{4}}$CH3CH2OOCCH2COOCH2CH3+2H2O;nHOOCCH2COOH+nOHCH2CH2OH$→_{△}^{催化剂}$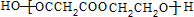 +(2n-1)H2O;
+(2n-1)H2O;
(3)G为CH3CH2OOCCH2COOCH2CH3,与G官能团完全相同、核磁共振氢谱有2组峰的任意一种同分异构体的结构简式如CH3OOCC(CH3)2COOCH3,
故答案为:CH3OOCC(CH3)2COOCH3;
(4)由上述M与必要的试剂可以合成一种农药的中间体马来酸酐,合成路线可知,M为BrCH2CH2Br,M发生信息(2)的反应生成X为HOOCCH2CH2COOH,X发生信息(1)的反应生成Y为HOOCCHClCH2COOH,则反应②的条件为氯气、催化剂,反应类型为取代反应,③为卤代烃的消去反应,反应条件为NaOH醇溶液、加热,
故答案为:HOOCCHClCH2COOH;
| 序号 | 所加试剂及条件 | 反应类型 |
| ② | 氯气、催化剂 | 取代反应 |
| ③ | NaOH醇溶液、加热 | 消去反应 |
点评 本题考查有机物的推断,为高频考点,把握有机物的组成、有机反应推断有机物为解答的关键,侧重分析与推断能力的考查,注意合成反应信息的应用,题目难度较大.

| A. | 3.2g的Cu与足量的浓HNO3反应生成的气体分子数为NA | |
| B. | pH=2的硫酸氢钠溶液中的硫酸根离子数为0.01NA | |
| C. | 8g CH4中含有的共价键总数为NA | |
| D. | 含有NA个中子的D2O的质量为2.0g |
| A. | 工业上通常把金属分为黑色金属和有色金属,铁属于黑色金属,是因为铁是黑色的 | |
| B. | 常温下,铁制容器可以用来贮存浓硫酸 | |
| C. | 铁的最高价是+3价,是因为铁原子的最外层有3个电子 | |
| D. | 在地壳中铁大多以游离态存在 |
| A. | Al2O3→NaAlO2 | B. | Cl2→HClO | C. | Al2O3→Al(OH)3 | D. | H2SO4(浓)→SO2 |
 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )| a | b | c | |
| A | Na | Na2O2 | NaCl |
| B | Cu | CuO | CuCl2 |
| C | HNO3 | NO | NO2 |
| D | SiO2 | H2SiO3 | Na2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  加热烧杯,除去NH4Cl中混有的I2 | B. | 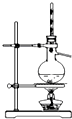 分离溴苯与苯的混合物 | ||
| C. | 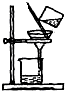 分离淀粉与葡萄糖的混合液 | D. | 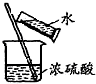 稀释浓硫酸 |
(1)同一周期内从左到右元素的金属性逐渐减弱;
(2)同一主族内从上到下元素的非金属性逐渐减弱.
从下表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写在答案的空格中.(不一定全选)
| 实验方法(Ⅰ) | 实验现象(Ⅱ) |
| A.钠与冷水反应 | a.溶液变红色 |
| B.向NaOH溶液中滴加酚酞 | b.产生白烟 |
| C.点燃H2S | c.反应不十分剧烈,产生的气体能燃烧 |
| D.蘸浓氨水与浓盐酸的两玻璃棒接近 | d.浮于水面,熔成小球,迅速向四处游动 |
| E.NaI溶液中加入溴水 | e.生成白色胶状沉淀,后又溶解 |
| F.镁带与沸水反应 | f.产生大量气泡、气体可以点燃 |
| G.AlCl3溶液中加入NaOH溶液 | g.溶液变棕黄色 |
| H.NaCl溶液中加入溴水 | h.发出耀眼的强光,生成白色物质 |
| I.镁带空气中燃烧 | i.发出淡蓝色火焰 |
| J.NaBr溶液中加入氯水 | j.观察不出什么现象 |
| K.铝片与2mnol/L盐酸反应 | k.溶液变橙色 |
| (1)同周期 | (2)同主族 | |
| Ⅰ | ||
| Ⅱ |
| A. | 1mL pH=2 的醋酸溶液加水稀释到10mL,pH 变为3 | |
| B. | 常温下,Na2CO3溶液中加水稀释时,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| C. | 向氯水中加入少量NaOH 溶液,一定有c(Na+)=c(Cl-)+c(ClO-) | |
| D. | NH4Cl 溶液稀释过程中,c(NH4+)与c(NH3•H2O)之和始终保持不变 |
| A. | 铁 | B. | 盐酸 | C. | 氯化钠 | D. | 氢氧化钠 |