题目内容
14.下列说法正确的是( )| A. | 1mL pH=2 的醋酸溶液加水稀释到10mL,pH 变为3 | |
| B. | 常温下,Na2CO3溶液中加水稀释时,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| C. | 向氯水中加入少量NaOH 溶液,一定有c(Na+)=c(Cl-)+c(ClO-) | |
| D. | NH4Cl 溶液稀释过程中,c(NH4+)与c(NH3•H2O)之和始终保持不变 |
分析 A.醋酸是弱电解质加水稀释促进电离;
B.Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-,加水平衡正移;
C.根据电荷守恒分析;
D.NH4Cl溶液稀释过程中浓度减小.
解答 解:A.醋酸是弱电解质加水稀释促进电离,溶液中氢离子的物质的量增大,所以1mL pH=2的醋酸溶液加水稀释到10mL,pH<3,故A错误;
B.Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-,加水平衡正移,HCO3-的物质的量增大,CO32-的物质的量减小,则碳酸氢根和碳酸根离子浓度比值增大,故B正确;
C.向氯水中加入少量NaOH溶液,溶液中存在电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(ClO-)+c(OH-),由于溶液显酸性,c(H+)>c(OH-),则c(Na+)<c(Cl-)+c(ClO-),故C错误;
D.NH4Cl溶液稀释过程中浓度减小,则c(NH4+)与c(NH3•H2O)之和逐渐减小,故D错误.
故选B.
点评 本题考查了弱电解质的电离平衡和盐的水解平衡的应用,难度不大,化学平衡移动原理同样适合水解平衡的移动,要多迁移,多联系.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
4.下列化学用语中错误的是( )
| A. | 钠的原子结构示意图: | B. | 甲烷的电子式: | ||
| C. | 异丁烷的结构简式: | D. | 偏铝酸钠的化学式:NaAlO2 |
2.日常生活中,我们常常接触到下列物品:①软排球 ②铝合金门窗 ③橡皮塞④大理石板 ⑤羊毛衫 ⑥铅笔芯 ⑦保鲜膜.其中主要是由有机高分子材料制成的一组是( )
| A. | ①②③⑤ | B. | ①③⑤⑦ | C. | ②③④⑤⑦ | D. | ①③⑥⑦ |
19.有7.8gA和0.1molB恰好完全反应后,生成10.6gC和1.6gD,则B的摩尔质量是( )
| A. | 44g/mol | B. | 78g/mol | C. | 106g/mol | D. | 88g/mol |
6.如果Fe3+、SO42-、Al3+和M四种离子以物质的量之比为1:5:2:1共同存在于同一种溶液中,那么M离子可能是( )
| A. | Mg2+ | B. | Ba2+ | C. | Na+ | D. | NO3- |
13.某化学小组探究酸性条件下NO3 -、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验). (忽略氧气对反应的影响)
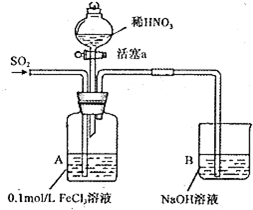
实验记录如下:
请回答下列问题:
(1)写出A装置中通入二氧化硫气体发生反应的离子方程式2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(2)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(3)实验III中,浅绿色溶液变为黄色的原因是在酸性条件下,NO3-把Fe2+氧化为Fe3+.(用语言叙述).
(4)实验IV若往A中通入空气,液面上方的现象是液面上方气体由无色变为红棕色.
(5)综合上述实验得岀的结论是:在酸性条件下,氧化性强弱顺序为NO3->Fe3+>SO42-.

实验记录如下:
| 实验 序号 | 实验操作 | 实验现象 |
| I | 向A装置中通入一段时间的SO2气体. | A中黄色溶液最终变为浅绿色. |
| II | 取出少量A装置中的溶液,先加入 KSCN溶液,再加入BaCl2溶液. | 加人KSCN溶液后溶液不变色;再加入BaCl2溶液产生白色沉淀. |
| III | 打开活塞a,将过量稀HNO3加入装置A 中,关闭活塞a. | A中浅绿色溶液最终变为黄色. |
| V | 取出少量A装置中的溶液,加入KSCN 溶液. | 溶液变为红色. |
(1)写出A装置中通入二氧化硫气体发生反应的离子方程式2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(2)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(3)实验III中,浅绿色溶液变为黄色的原因是在酸性条件下,NO3-把Fe2+氧化为Fe3+.(用语言叙述).
(4)实验IV若往A中通入空气,液面上方的现象是液面上方气体由无色变为红棕色.
(5)综合上述实验得岀的结论是:在酸性条件下,氧化性强弱顺序为NO3->Fe3+>SO42-.
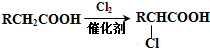
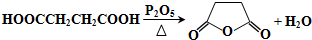
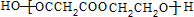 +(2n-1)H2O.
+(2n-1)H2O.
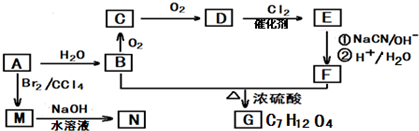
 A、B、C、D、E为初中化学常见的物质,相互之间存在以下转化关系.其中A是一种盐,广泛应用于玻璃、造纸、纺织和洗涤剂的生产等;D是大理石的主要成分,大量用于建筑业.请回答:
A、B、C、D、E为初中化学常见的物质,相互之间存在以下转化关系.其中A是一种盐,广泛应用于玻璃、造纸、纺织和洗涤剂的生产等;D是大理石的主要成分,大量用于建筑业.请回答: 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.