题目内容
16.五千多年前,人类就开始了对铁的使用.下列有关铁的说法中正确的是( )| A. | 工业上通常把金属分为黑色金属和有色金属,铁属于黑色金属,是因为铁是黑色的 | |
| B. | 常温下,铁制容器可以用来贮存浓硫酸 | |
| C. | 铁的最高价是+3价,是因为铁原子的最外层有3个电子 | |
| D. | 在地壳中铁大多以游离态存在 |
分析 A.钢铁表面常覆盖一层黑色的四氧化三铁,所以习惯把铁称为黑色金属,实际上纯净的铁是银白色的;
B.常温下铁与浓硫酸发生钝化现象,阻止了反应的继续进行;
C.铁原子的最外层有2个电子,属于副族元素,可以失去最外层电子,也可以失去次外层电子;
D.地壳中大多数元素以化合态存在,只有少数的元素为游离态.
解答 解:A.纯净的是银白色的,铁属于黑色金属是由于钢铁表面常覆盖一层黑色的四氧化三铁,习惯把铁称为黑色金属,故A错误;
B.常温下,铁制容器可以用来贮存浓硫酸,是由于铁在常温下与浓硫酸发生钝化现象,故B正确;
C.Fe元素为26号元素,原子核外有26个电子,其核外电子排布式为:1s22s22p63s23p63d64s2,所以铁最外层含有2个电子,故C错误;
D.在地壳中大多元素以化合态存在,只有少量的元素才以化合态形式存在,故D错误;
故选B.
点评 本题考查了铁的性质,题目难度不大,明确常见元素及其化合物性质为解答关键,注意掌握铁的原子结构及性质,试题侧重基础知识的考查,有利于培养学生的灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.某温度下.在一容积不变的密闭容器中充入2molSO2和1molO2,一段时间后反应达到平衡状态,测得平衡时的压强为反应前的0.8倍.则SO2的转化率为( )
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
4.下列化学用语中错误的是( )
| A. | 钠的原子结构示意图: | B. | 甲烷的电子式: | ||
| C. | 异丁烷的结构简式: | D. | 偏铝酸钠的化学式:NaAlO2 |
11.N5是破坏力极强的炸药之一,18O2是比黄金还贵重的物质.下列说法正确的是( )
| A. | 2N5 →5N2是化学变化 | B. | N5和N2互为同位素 | ||
| C. | 原子半径:r(N)<r(O) | D. | 18O2中含18个中子 |
1.下表是元素周期表的一部分.
(1)表中元素⑩的氢化物的化学式为HCl,此氢化物的还原性比元素⑨的氢化物的还原性弱(填强或弱).
(2)在⑦、⑧、⑨、⑩4种元素中,原子半径最大的是Mg(填元素符号),其原子结构示意图为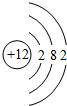 .
.
(3)写出⑤元素的最高价氧化物的水化物与其气态氢化物发生反应的化学方程式:NH3+HNO3═NH4NO3.
(4)写出元素⑦的氯化物的水溶液与NaOH溶液反应的离子方程式:Mg2++2OH-═Mg(OH)2↓.
(5)要证明⑥元素比⑨元素的氧化性强的化学方程式为:2H2S+O2═2H2O+2S↓.
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)在⑦、⑧、⑨、⑩4种元素中,原子半径最大的是Mg(填元素符号),其原子结构示意图为
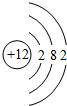 .
.(3)写出⑤元素的最高价氧化物的水化物与其气态氢化物发生反应的化学方程式:NH3+HNO3═NH4NO3.
(4)写出元素⑦的氯化物的水溶液与NaOH溶液反应的离子方程式:Mg2++2OH-═Mg(OH)2↓.
(5)要证明⑥元素比⑨元素的氧化性强的化学方程式为:2H2S+O2═2H2O+2S↓.
8.下列物质中,从化学键的角度看,有一种与其他三种明显不同,这种物质是( )
| A. | NaOH | B. | N2 | C. | SO2 | D. | H2O |
6.如果Fe3+、SO42-、Al3+和M四种离子以物质的量之比为1:5:2:1共同存在于同一种溶液中,那么M离子可能是( )
| A. | Mg2+ | B. | Ba2+ | C. | Na+ | D. | NO3- |
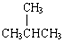 ;④CH4与C3H8;⑤CH3CH2CH2CH3与
;④CH4与C3H8;⑤CH3CH2CH2CH3与 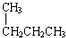 .请回答下列问题:
.请回答下列问题: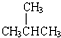 的名称是2-甲基丙烷.
的名称是2-甲基丙烷.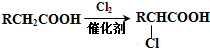
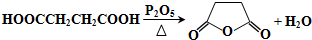
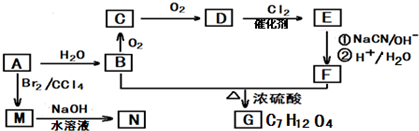
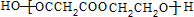 +(2n-1)H2O.
+(2n-1)H2O.