题目内容
13.下列物质的变化,不能通过一步化学反应完成的是( )| A. | Al2O3→NaAlO2 | B. | Cl2→HClO | C. | Al2O3→Al(OH)3 | D. | H2SO4(浓)→SO2 |
分析 A.Al与NaOH反应生成NaAlO2;
B.氯气与水反应生成HClO;
C.Al2O3不能与水或碱反应生成Al(OH)3;
D.浓硫酸与Cu在加热条件下反应生成二氧化硫.
解答 解:A.Al与NaOH反应生成NaAlO2,发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,一步转化可实现,故A不选;
B.氯气与水反应生成HClO,发生Cl2+H2O=HCl+HClO,一步转化可实现,故B不选;
C.Al2O3不能与水或碱反应生成Al(OH)3,不能实现一步转化,故C选;
D.浓硫酸与Cu在加热条件下反应生成二氧化硫,发生Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O,一步转化可实现,故D不选;
故选C.
点评 本题考查物质的性质,综合考查元素化合物知识,把握物质的性质及发生的化学反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.氯乙烯是合成高聚物聚氯乙烯的单体,工业制取氯乙烯需要以下反应:①乙炔与氯化氢反应生成氯乙烯 ②高温煅烧石灰石 ③电解饱和食盐水 ④制取乙炔 ⑤制取乙烯 ⑥合成氯化氢 ⑦制取水煤气 ⑧制取盐酸 ⑨制取电石,则制取氯乙烯的正确操作是( )
| A. | ③→⑧→①←④→⑨ | B. | ⑦→③→⑥→①←④→⑨→② | C. | ②→⑨→④→①←⑥←③ | D. | ②→④→⑤→①←⑥←③ |
4.下列化学用语中错误的是( )
| A. | 钠的原子结构示意图: | B. | 甲烷的电子式: | ||
| C. | 异丁烷的结构简式: | D. | 偏铝酸钠的化学式:NaAlO2 |
1.下表是元素周期表的一部分.
(1)表中元素⑩的氢化物的化学式为HCl,此氢化物的还原性比元素⑨的氢化物的还原性弱(填强或弱).
(2)在⑦、⑧、⑨、⑩4种元素中,原子半径最大的是Mg(填元素符号),其原子结构示意图为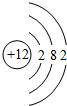 .
.
(3)写出⑤元素的最高价氧化物的水化物与其气态氢化物发生反应的化学方程式:NH3+HNO3═NH4NO3.
(4)写出元素⑦的氯化物的水溶液与NaOH溶液反应的离子方程式:Mg2++2OH-═Mg(OH)2↓.
(5)要证明⑥元素比⑨元素的氧化性强的化学方程式为:2H2S+O2═2H2O+2S↓.
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)在⑦、⑧、⑨、⑩4种元素中,原子半径最大的是Mg(填元素符号),其原子结构示意图为
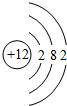 .
.(3)写出⑤元素的最高价氧化物的水化物与其气态氢化物发生反应的化学方程式:NH3+HNO3═NH4NO3.
(4)写出元素⑦的氯化物的水溶液与NaOH溶液反应的离子方程式:Mg2++2OH-═Mg(OH)2↓.
(5)要证明⑥元素比⑨元素的氧化性强的化学方程式为:2H2S+O2═2H2O+2S↓.
8.下列物质中,从化学键的角度看,有一种与其他三种明显不同,这种物质是( )
| A. | NaOH | B. | N2 | C. | SO2 | D. | H2O |
2.日常生活中,我们常常接触到下列物品:①软排球 ②铝合金门窗 ③橡皮塞④大理石板 ⑤羊毛衫 ⑥铅笔芯 ⑦保鲜膜.其中主要是由有机高分子材料制成的一组是( )
| A. | ①②③⑤ | B. | ①③⑤⑦ | C. | ②③④⑤⑦ | D. | ①③⑥⑦ |
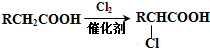
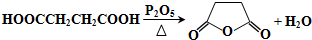
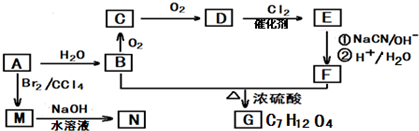
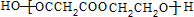 +(2n-1)H2O.
+(2n-1)H2O.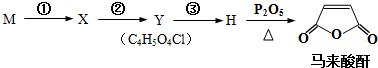
 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.