题目内容
17.验证周期表中元素性质的变化规律:(1)同一周期内从左到右元素的金属性逐渐减弱;
(2)同一主族内从上到下元素的非金属性逐渐减弱.
从下表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写在答案的空格中.(不一定全选)
| 实验方法(Ⅰ) | 实验现象(Ⅱ) |
| A.钠与冷水反应 | a.溶液变红色 |
| B.向NaOH溶液中滴加酚酞 | b.产生白烟 |
| C.点燃H2S | c.反应不十分剧烈,产生的气体能燃烧 |
| D.蘸浓氨水与浓盐酸的两玻璃棒接近 | d.浮于水面,熔成小球,迅速向四处游动 |
| E.NaI溶液中加入溴水 | e.生成白色胶状沉淀,后又溶解 |
| F.镁带与沸水反应 | f.产生大量气泡、气体可以点燃 |
| G.AlCl3溶液中加入NaOH溶液 | g.溶液变棕黄色 |
| H.NaCl溶液中加入溴水 | h.发出耀眼的强光,生成白色物质 |
| I.镁带空气中燃烧 | i.发出淡蓝色火焰 |
| J.NaBr溶液中加入氯水 | j.观察不出什么现象 |
| K.铝片与2mnol/L盐酸反应 | k.溶液变橙色 |
| (1)同周期 | (2)同主族 | |
| Ⅰ | ||
| Ⅱ |
分析 要证明元素的金属性强弱,可利用金属与酸(或水)的反应;
要证明元素的非金属性强弱,可利用单质之间的置换反应,非金属性强的元素的单质可以置换非金属弱的;
解答 解:(1)要证明元素的金属性强弱,可利用金属与酸(或水)的反应,反应越剧烈,金属性越强;
钠与冷水反应,浮于水面,熔成小球,迅速向四处游动,反应非常剧烈;
镁带与沸水反应,再向反应后溶液中滴加酚酞.镁与2mol/L盐酸反应,反应不十分剧烈,产生的气体能燃烧,溶液变成浅红色.与酸反应剧烈,产生大量气泡且可以燃烧;
铝片与2mol/L盐酸反应,产生大量气泡、气体可以燃烧;
由此可知,金属与酸(或水)的反应剧烈程度:Na>Mg>Al;
NaBr溶液中加入氯水和CCl4,下层溶液变橙色,说明氯气置换了溴,则非金属性Cl>Br;
NaI溶液中加入溴水和CCl4,下层溶液变棕黄色,说明溴置换了碘,则非金属性Br>I;
则实验操作与实验现象对应为:
| 1、探究同一周期 | 2、探究同一主族 | |||||||
| Ⅰ | A | F | K | E | J | |||
| Ⅱ | d | f | c | g | k | |||
| 1、探究同一周期 | 2、探究同一主族 | |||||||
| Ⅰ | A | F | K | E | J | |||
| Ⅱ | d | f | c | g | k | |||
点评 本题考查了探究金属单质的金属性强弱、非金属单质的非金属性强弱方法,题目难度中等,正确掌握判断金属性、非金属性强弱的方法是解题的关键.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
7.某温度下.在一容积不变的密闭容器中充入2molSO2和1molO2,一段时间后反应达到平衡状态,测得平衡时的压强为反应前的0.8倍.则SO2的转化率为( )
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
8.下列物质中,从化学键的角度看,有一种与其他三种明显不同,这种物质是( )
| A. | NaOH | B. | N2 | C. | SO2 | D. | H2O |
12.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 7.8gNa2O2中所含有的阴离子数目是0.2NA | |
| B. | 标准状况下,2.24L18O2中含有的中子的数目是NA | |
| C. | 在20℃、1.01×105 Pa时,2.8g C2H4和CO的混合气体含气体分子数是0.1 NA | |
| D. | 标准状况下,a L CH4和a L C6H14中所含分子数均约为$\frac{a{N}_{A}}{22.4}$ |
2.日常生活中,我们常常接触到下列物品:①软排球 ②铝合金门窗 ③橡皮塞④大理石板 ⑤羊毛衫 ⑥铅笔芯 ⑦保鲜膜.其中主要是由有机高分子材料制成的一组是( )
| A. | ①②③⑤ | B. | ①③⑤⑦ | C. | ②③④⑤⑦ | D. | ①③⑥⑦ |
6.如果Fe3+、SO42-、Al3+和M四种离子以物质的量之比为1:5:2:1共同存在于同一种溶液中,那么M离子可能是( )
| A. | Mg2+ | B. | Ba2+ | C. | Na+ | D. | NO3- |
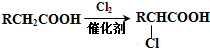
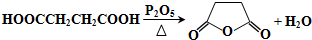
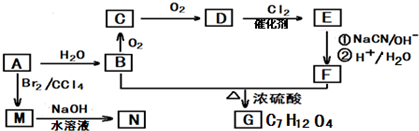
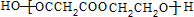 +(2n-1)H2O.
+(2n-1)H2O.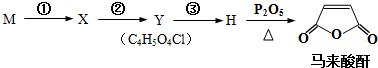
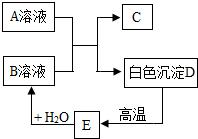 A、B、C、D、E为初中化学常见的物质,相互之间存在以下转化关系.其中A是一种盐,广泛应用于玻璃、造纸、纺织和洗涤剂的生产等;D是大理石的主要成分,大量用于建筑业.请回答:
A、B、C、D、E为初中化学常见的物质,相互之间存在以下转化关系.其中A是一种盐,广泛应用于玻璃、造纸、纺织和洗涤剂的生产等;D是大理石的主要成分,大量用于建筑业.请回答: