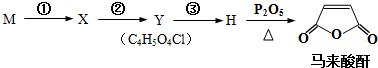
题目内容
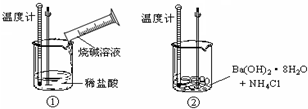
10.下列装置能实现实验目的是( )| A. | 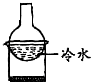 加热烧杯,除去NH4Cl中混有的I2 | B. | 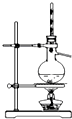 分离溴苯与苯的混合物 | ||
| C. | 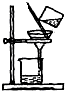 分离淀粉与葡萄糖的混合液 | D. | 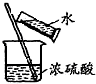 稀释浓硫酸 |
分析 A.碘受热易升华,氯化铵在加热条件下发生分解反应生成HCl和氨气,冷却时碘蒸气变为固态碘,HCl和氨气反应生成氯化铵固体;
B.互溶且熔沸点相差较大的液体采用蒸馏方法分离;
C.胶体和溶液都能透过滤纸,但胶体不能透过半透膜而溶液能透过半透膜;
D.溶液稀释时将密度大的液体倒入密度小的液体.
解答 解:A.碘受热易升华,氯化铵在加热条件下发生分解反应生成HCl和氨气,冷却时碘蒸气变为固态碘,HCl和氨气反应生成氯化铵固体,所以不能采用加热、冷却的方法除去氯化铵中的碘,故A错误;
B.互溶且熔沸点相差较大的液体采用蒸馏方法分离,溴苯和苯互溶且熔沸点相差较大,可以采用蒸馏方法分离提纯,故B正确;
C.胶体和溶液都能透过滤纸,但胶体不能透过半透膜而溶液能透过半透膜,淀粉溶液属于胶体,葡萄糖溶液属于溶液,所以淀粉和葡萄糖溶液应该采用渗析方法分离提纯,故C错误;
D.溶液稀释时将密度大的液体倒入密度小的液体,浓硫酸密度大于水,则浓硫酸稀释时,应该将浓硫酸倒入水中并不断搅拌,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质分离提纯、溶液稀释等知识点,侧重考查学生分析比较判断能力,明确物质性质差异性及物质分离提纯方法的选取是解本题关键,注意浓硫酸稀释方法,为易错点.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
1.下表是元素周期表的一部分.
(1)表中元素⑩的氢化物的化学式为HCl,此氢化物的还原性比元素⑨的氢化物的还原性弱(填强或弱).
(2)在⑦、⑧、⑨、⑩4种元素中,原子半径最大的是Mg(填元素符号),其原子结构示意图为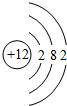 .
.
(3)写出⑤元素的最高价氧化物的水化物与其气态氢化物发生反应的化学方程式:NH3+HNO3═NH4NO3.
(4)写出元素⑦的氯化物的水溶液与NaOH溶液反应的离子方程式:Mg2++2OH-═Mg(OH)2↓.
(5)要证明⑥元素比⑨元素的氧化性强的化学方程式为:2H2S+O2═2H2O+2S↓.
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)在⑦、⑧、⑨、⑩4种元素中,原子半径最大的是Mg(填元素符号),其原子结构示意图为
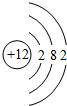 .
.(3)写出⑤元素的最高价氧化物的水化物与其气态氢化物发生反应的化学方程式:NH3+HNO3═NH4NO3.
(4)写出元素⑦的氯化物的水溶液与NaOH溶液反应的离子方程式:Mg2++2OH-═Mg(OH)2↓.
(5)要证明⑥元素比⑨元素的氧化性强的化学方程式为:2H2S+O2═2H2O+2S↓.
15.一些科学家预言,存在稳定的超重元素,如114个质子和184个中子的原子,它位于元素周期表的第七周期IVA族,由此下列说法正确的是( )
| A. | 第七周期元素共有50种 | |
| B. | 该元素原子的质量数是184 | |
| C. | 该元素的相对原子质量是298 | |
| D. | 该元素的原子核外有114个电子,最外层有4个电子 |
2.日常生活中,我们常常接触到下列物品:①软排球 ②铝合金门窗 ③橡皮塞④大理石板 ⑤羊毛衫 ⑥铅笔芯 ⑦保鲜膜.其中主要是由有机高分子材料制成的一组是( )
| A. | ①②③⑤ | B. | ①③⑤⑦ | C. | ②③④⑤⑦ | D. | ①③⑥⑦ |
19.有7.8gA和0.1molB恰好完全反应后,生成10.6gC和1.6gD,则B的摩尔质量是( )
| A. | 44g/mol | B. | 78g/mol | C. | 106g/mol | D. | 88g/mol |
9.25℃时,水的电离达到平衡:H2O?H++OH-,下列叙述正确的是( )
| A. | 将水加热,Kw增大,pH不变 | |
| B. | 向水中加入少量盐酸,c(H+)增大,Kw不变 | |
| C. | 向水中加入NaOH固体,平衡逆向移动,c(OH-)降低 | |
| D. | 向水中加入AlCl3固体,平衡正向移动,c(OH-)增大 |
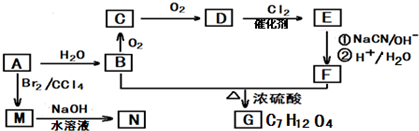
 (代号DMP)是一种常用的酯类塑化剂,其蒸汽对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸汽对氢气的相对密度为97.工业上生产DMP的流程如图所示:
 的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基.
的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基.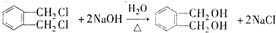 .
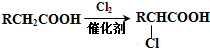
.
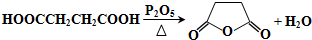
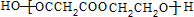 +(2n-1)H2O.
+(2n-1)H2O.