题目内容
16.光纤通讯是光导纤维传送信号的一种通讯手段,合成光导纤维及氮化硅(一种无机涂层)的工艺流程如图:
回答下列问题:
(1)反应I的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,其中还原剂为C(填化学式),该反应涉及的副反应可能有(碳不足)C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑和(碳足量)3C+SiO2$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
(2)经反应Ⅱ所得的四氯化硅粗品中所含的物质如表:
| 组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
| 质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
| 沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
 .
.(3)已知反应Ⅳ的化学方程式为3SiCl4+4NH3$\frac{\underline{\;1400℃\;}}{\;}$Si3N4+12HCl,则反应Ⅲ和Ⅳ中尾气的用途为制取盐酸.若向一2L恒容密闭容器中投入1mol SiC14和1mol NH3,6min后反应完全,则0~6min内,HCl的平均反应速率为0.25 mol•L-l•min-l.
分析 根据流程反应I为焦炭和石英砂高温条件下发生反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,反应Ⅱ主要为Si与氯气高温反应生成SiCl4,根据所得的四氯化硅粗品中所含的物质的沸点不同,经过精馏(或蒸馏或分馏)得到纯SiCl4,反应Ⅲ为SiCl4与氢气、氧气在1500℃时反应SiCl4+O2+2H2$\frac{\underline{\;1500℃\;}}{\;}$SiO2+4HCl,反应IV为SiCl4与NH3在1400℃时反应3SiCl4+4NH3$\frac{\underline{\;1400℃\;}}{\;}$Si3N4+12HCl,
(1)还原剂失去电子发生氧化反应;碳足量时,生成碳化硅和CO;
(2)根据表中数据分析;PCl3为共价化合物;
(3)反应Ⅲ和Ⅳ中尾气为氯化氢气体;根据v=$\frac{△c}{△t}$计算.
解答 解:(1)反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑中,C元素化合价升高被氧化,为还原剂;),该反应涉及的副反应可能有(碳不足)C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑和(碳足量)3C+SiO2$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑;
故答案为:C;3C+SiO2$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑;
(2)根据所得的四氯化硅粗品中所含的物质的沸点不同,经过蒸馏得到纯SiCl4,所以“操作X”的名称为精馏(或蒸馏或分馏),PCl3为共价化合物,则电子式为: ;
;
故答案为:精馏(或蒸馏或分馏); ;
;
(3)反应Ⅲ为SiCl4与氢气、氧气在1500℃时反应生成SiO2和HCl,方程式为:SiCl4+O2+2H2$\frac{\underline{\;1500℃\;}}{\;}$SiO2+4HCl,反应IV为SiCl4与NH3在1400℃时反应生成Si3N4和HCl,方程式为:3SiCl4+4NH3$\frac{\underline{\;1400℃\;}}{\;}$Si3N4+12HCl,所以反应III和IV中尾气HCl的用途为制取盐酸,
若向一2L恒容密闭容器中投入1mol SiC14和1mol NH3,发生反应3SiCl4+4NH3$\frac{\underline{\;1400℃\;}}{\;}$Si3N4+12HCl,SiC14过量,氨气反应完全,6min后反应完全,则生成的n(HCl)=3mol,0~6min内,HCl的平均反应速率为$\frac{3mol÷2L}{6min}$=0.25mol•L-l•min-l;
故答案为:制取盐酸;0.25.
点评 本题考查物质的制备实验方案的设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把物质的性质和物质反应量的关系.

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案| A. | BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| C. | 己知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ•mol-1,则水电离的热化学方程式为:H2O(l)?H+ (aq)+OH-(aq)△H=+57.3 kJ•mol-1 | |
| D. | 向0.1mol/L的CH3COONa溶液中加入少量醋酸钠固体,c(CH3COO-)/c(Na+ )变大 |
| A. | 反应掉的三种金属的质量相等 | B. | 反应后三种金属质量相等 | ||
| C. | 所用盐酸均过量 | D. | 三种金属可以都有剩余 |
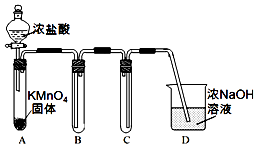 某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.I.用高锰酸钾和浓盐酸反应制取氯气
(1)该小组利用如图装置及试剂制备并收集适量Cl2,装置B中收集的气体中所含的杂质有HCl、H2O(g),D的作用是吸收C中逸出的Cl2.
(2)制得的氯气中加入适量水,得到饱和氯水,
饱和氯水中含氯元素的微粒有Cl-、Cl2、ClO-、HClO(写出全部微粒的化学式).
(3)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一.在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强.
①滤液漂白性增强的原因是氯水中存在平衡Cl2+H2O?H++Cl-+HClO,CaCO3与盐酸反应,平衡正向移动,增大了HClO的浓度,漂白效果增强(用化学平衡移动原理解释).
②已知H2CO3的第二电离常数K2=5.6×10-11,HClO的电离常数K=3.0×10-8,写出Cl2与Na2CO3溶液按物质的量之比1:1恰好反应的离子方程式Cl2+H2O+CO32-=HCO3-+HClO+Cl-.
Ⅱ.ClO3-、Cl-和H+反应的探究
(4)KClO3、KCl与硫酸可以反应.该小组设计了系列实验研究反应条件对反应的影响,实验记录如表(实验在室温下进行):
| 烧杯编号 | 1 | 2 | 3 | 4 |
| 氯酸钾饱和溶液 | 1mL | V1mL | V2mL | V3mL |
| 氯化钾固体 | 1g | 1g | 1g | 1g |
| 水 | 8mL | V4mL | 3mL | 0mL |
| 硫酸(6mol/L) | V5mL | 2mL | V6mL | 8mL |
| 现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 |
②烧杯2加水的体积V4应为6 mL,烧杯4中的现象溶液呈黄绿色,生成黄绿色气体.
(5)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色.设计最简单的实验验证Cl2中含有ClO2收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化.
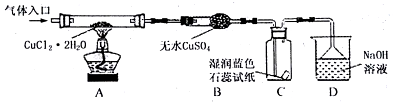
阅读资料:
| 资料一 | CuCl2•2H2O | 在HCl气流中加热至140℃ | 产生CuCl2 | CuCl2在受热大于300℃时 | 生成CuCl和Cl2 |
| 资料二 | CuCl2•2H2O | 直接加热 | 产生Cu2(OH)2Cl2 | Cu2(OH)2Cl2在受热到200℃时 | 产生CuO |
(1)请在表中填写实验操作的步骤.
| 步骤 | 操作描述 |
| ① | 检验装置的气密性后加药品 |
| ② | 在“气体入口”处通干燥HCl |
| ③ | 点燃酒精灯,加热 |
| ④ | 熄灭酒精灯,冷却 |
| ⑤ | 停止通入HCl,然后通入N2 |
(3)装置D的作用是收尾气氯气和氯化氢:Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(4)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析其原因:
①若杂质是CuCl2,则产生的原因是加热温度不够.
②若杂质是CuO,则产生的原因是HCl气流不足.
(5)在不了解CuCl化学性质的前提下,如何证明实验得到的CuCl样品中含有CuCl2杂质对反应后得到的产品进行称量,求出agCuCl2•2H2O完全转化为CuCl的质量,如果该数值小于产品的称量值,就可判断含有氯化铜.
| 实验操作 | 相应实验现象 | 结论或推论 | |
| A | 溴水中加入苯,充分振荡、静置 | 水层几乎呈无色 | 苯与溴发生了反应 |
| B | 一小粒金属钠投入装有无水乙醇的试管中 | 反应结束前一段时间,钠浮在乙醇表面 | 密度:乙醇大于钠 |
| C | 分别向盛有KI3溶液的a、b试管中滴加淀粉溶液和AgNO3溶液 | a中溶液变蓝,b中产生黄色沉淀 | KI3溶液中存在:I3-?I2+I- |
| D | 分别向含Mn2+的草酸溶液X和不含Mn2+的草酸溶液Y中滴加酸性高锰酸钾溶液 | 高锰酸钾溶液在X溶液中褪色较快 | Mn2+也能还原高锰酸钾 |
| A. | A | B. | B | C. | C | D. | D |