题目内容
20.向含Fe2(SO4)3、CuCl2、H2SO4的混合溶液中投入足量的Fe粉,充分反应后,剩余的固体物质经干燥,称得其质量比加入的铁粉质量减轻16g,此时溶液中c(Fe2+)是原混合液中c(Cu2+)的3倍(反应前后体积没有变化),溶液中c(SO42-)与c(Cl-)之比是( )| A. | 1:2 | B. | 2:1 | C. | 1:3 | D. | 1:1 |
分析 向含Fe2(SO4)3、CuCl2、H2SO4的混合溶液中投入足量的Fe粉,充分反应,发生反应Fe+CuCl2=Cu+FeCl2,Fe+Fe2(SO4)3=3FeSO4,Fe+H2SO4=FeSO4+H2↑,
反应前固体为铁,设其物质的量为x,反应后只有铜,设其物质的量为y,依据质量关系列式得到(1)56x-64y=16g,
由于氧化还原反应过程中存在电子守恒,铁总共失去电子数2x,铜离子得到2y个电子,剩下的电子最终都是在二价铁离子中,可知溶液最后的二价铁离子的量$\frac{2x-2y}{2}$+x=2x-y,而已知反应后二甲铁离子与反应前铜离子的比例为3:1,(2)(2x-y):y=3:1,
联立(1)(2)计算得到y=$\frac{1}{3}$,2x-y=1,结合元素守恒计算.
解答 解:反应前固体为铁,设其物质的量为x,反应后只有铜,设其物质的量为y,
依据质量关系列式得到(1)56x-64y=16g,
由于氧化还原反应过程中存在电子守恒,铁总共失去电子数2x,铜离子得到2y个电子,剩下的电子最终都是在二价铁离子中,可知溶液最后的二价铁离子的量$\frac{2x-2y}{2}$+x=2x-y,
而已知反应后二甲铁离子与反应前铜离子的比例为3:1,(2)(2x-y):y=3:1,
联立(1)56x+64y=16g
(2)(2x-y):y=3:1
计算得到y=$\frac{1}{3}$,2x-y=1,
由氯化铜中元素守恒和氯元素的量为2y=$\frac{2}{3}$,
电荷守恒可知硫酸根离子物质的量[2(x-y)×2-$\frac{2}{3}$]×$\frac{1}{2}$=$\frac{2}{3}$,
硫酸根离子和氯离子物质的量之比为1:1,
故选D
点评 本题考查了物质性质、氧化还原反应顺序、元素守恒、电子守恒的计算应用,题目难度较大.

 习题精选系列答案
习题精选系列答案
回答下列问题:
(1)反应I的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,其中还原剂为C(填化学式),该反应涉及的副反应可能有(碳不足)C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑和(碳足量)3C+SiO2$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
(2)经反应Ⅱ所得的四氯化硅粗品中所含的物质如表:
| 组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
| 质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
| 沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
 .
.(3)已知反应Ⅳ的化学方程式为3SiCl4+4NH3$\frac{\underline{\;1400℃\;}}{\;}$Si3N4+12HCl,则反应Ⅲ和Ⅳ中尾气的用途为制取盐酸.若向一2L恒容密闭容器中投入1mol SiC14和1mol NH3,6min后反应完全,则0~6min内,HCl的平均反应速率为0.25 mol•L-l•min-l.
| A. | Na | B. | Mg | C. | A1 | D. | Cl |
| A. | 移走少量C | B. | 扩大容积,减小压强 | ||
| C. | 缩小容积,增大压强 | D. | 容积不变,充入“惰”气 |
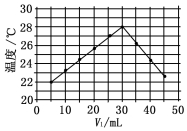 将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A. | 做该实验时环境温度为22℃ | |
| B. | 该实验表明可将热能转化为化学能 | |
| C. | NaOH溶液的浓度约为1.5 mol•L-1 | |
| D. | 该实验表明有水生成的反应都是放热反应 |
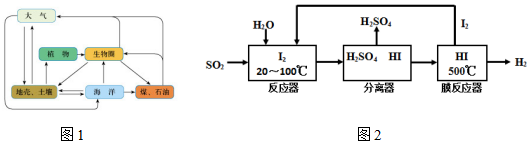
(1)有关叙述中不正确的是ac(填序号)
a.自然界不存在游离态的硫
b.部分硫元素由地壳到大气的过程发生了氧化反应
c.图1显示大气中的二氧化硫最终回到海洋并很快和其它矿物形成煤和石油
d.葡萄酒中含有二氧化硫可防止葡萄酒被氧化
(2)硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2而获得清洁能源.
①该循环工艺过程的总反应方程式为SO2+2H2O=H2+H2SO4.
②FeS2可和盐酸发生复分解反应生成一种不稳定的液态化合物,该化合物的电子式

③用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是减小生成物浓度,平衡正向移动,提高HI的分解率.
④已知下列三个反应:
a Cl(g)+H(g)═HCl(g)△H1 b Br(g)+H(g)═HBr(g)△H2 c I(g)+H(g)═HI(g)△H3
则△H1、△H2、△H3由大到小的顺序为△H3>△H2>△H1,用原子结构解释原因Cl、Br、I为同主族元素,从上至下,原子半径依次知道,非金属性依次减弱,氢化物稳定性依次减弱.
(3)工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.
表是不同压强、温度时SO2的转化率情况.
压强 温度℃ | 0.2Mpa | 1.0Mp | 10Mpa |
| 400 | 97.2% | 99.5% | 99.7% |
| 500 | 91.5% | 96.9% | 97.8% |
| 600 | 72.6% | 85.8% | 89.5% |
(4)下列事实能说明H2SO3的酸性强于H2CO3的是b
a.饱和H2SO3溶液的pH小于饱和H2CO3溶液的pH.
b.同温下,等浓度的NaHSO3和NaHCO3溶液,后者的pH值大.
c.H2SO3能使酸性高锰酸钾溶液褪色,而H2CO3不能.
d.将过量SO2气体通入NaHCO3溶液中,逸出的气体能使澄清石灰水变浑浊.
| A. | 根据对角线规则,铍和铝的性质具有相似性 | |
| B. | 在H3O+、NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | O3与SO2的结构相似 | |
| D. | P4和CH4都是正四面体分子且键角都为109°28ˊ |
| 选项 | 实验内容 | 实验目的 |
| A | 用注射器收集铜与浓硝酸反应生成的气体,然后推拉注射器 | 研究压强对化学平衡移动的影响 |
| B | 在实验室制得的乙酸乙酯中加入饱和碳酸钠溶液,然后蒸馏 | 除去乙酸乙酯中混有的乙酸、乙醇 |
| C | 用饱和FeCl3溶液制得Fe(OH)3胶体,然后过滤 | 提纯Fe (OH)3胶体 |
| D | 往混有FeCl2的CuCl2溶液中加人H2O2后,用氨水调节pH 至2.7 后过滤 | 除去CuCl2溶液中FeCl2杂质 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  | B. |  | C. |  | D. |  |