题目内容
7.等物质的量的Fe、Mg、Al与同体积、同浓度的HCl反应,产生H2的体积相同(相同状况),下列判断正确的是( )| A. | 反应掉的三种金属的质量相等 | B. | 反应后三种金属质量相等 | ||
| C. | 所用盐酸均过量 | D. | 三种金属可以都有剩余 |
分析 设三种金属的物质的量均为1mol,2Na+2HCl=2NaCl+H2↑,Mg+2HCl=MgCl2+H2↑,2Al+6HCl=AlCl3+3H2↑,但是,无论盐酸是否足量,钠都能完全反应,因为还有水跟钠反应.可建立关系Na~HCl~0.5H2,0.5Mg~HCl~0.5H2,$\frac{1}{3}$Al~HCl~0.5H2↑,据此进行分析.
解答 解:设三种金属的物质的量均为1mol,2Na+2HCl=2NaCl+H2↑,Mg+2HCl=MgCl2+H2↑,2Al+6HCl=AlCl3+3H2↑,但是,无论盐酸是否足量,钠都能完全反应,因为还有水跟钠反应.可建立关系Na~HCl~0.5H2,0.5Mg~HCl~0.5H2,$\frac{1}{3}$Al~HCl~0.5H2↑,
A.生成0.5molH2消耗Na,Mg,Al的物质的量分别为1mol,0.5mol,$\frac{1}{3}$mol,据m=nM,故质量分别为23g,12g,9g,故反应掉三种金属的质量不等,故A错误;
B.设三种金属的物质的量均为1mol,则1molNa,Mg,Al的质量分别为23g,24g,27g,由A得反应掉三种金属的质量分别为23g,12g,9g,故反应后三种金属的质量为0g,12g,18g,故故反应后三种金属的质量不等,故B错误;
C.Na~HCl~0.5H2,0.5Mg~HCl~0.5H2,$\frac{1}{3}$Al~HCl~0.5H2↑,生成等物质的量氢气,故盐酸的量相等,化学计算时应该以不足的作为计算对象,故盐酸不足,故C错误;
D.由C得盐酸不足,则三种金属都可以有剩余,故D正确;
故选D.
点评 本题考查学生金属和酸反应的有关计算知识,注意知识的归纳和梳理是重点,本题侧重解题方法的应用,难度不大.

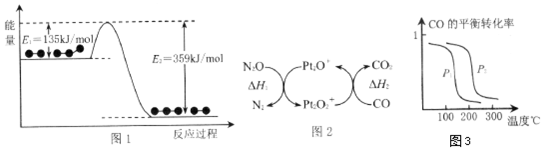
 常温下,在10mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )| A. | 在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-) | |
| B. | 当溶液的pH为7时,溶液的总体积大于20mL | |
| C. | 在B点所示的溶液中,浓度最大的离子是HCO3- | |
| D. | 在0.1 mol•L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| B | 溴乙烷与NaOH溶液共热后,加入AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷没有水解 |
| C | 向等浓度的KCl、KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4, 振荡,静置 | 下层液体显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
| X | Y | Z | T | |
| L |
| A. | 原子半径:X<Y<Z<T<L | |
| B. | 气态氢化物的还原性:L>Z>T | |
| C. | 含x的两种盐溶液混合可能生成沉淀 | |
| D. | Y的含氧酸的酸性小于T的含氧酸 |
| A. | 标准状况下,33.6L HF中含有氟原子的数目为1.5NA | |
| B. | 常温下,2.7g金属铝与足量浓度为18.4mol/L的浓H2SO4反应时转移的电子数为0.3NA | |
| C. | Na2O与Na2O2的混合物共1mol,阴离子数目为NA | |
| D. | CH4与P4的分子结构都是正四面体,每1mol CH4分子与P4分子都含有4NA个共价键 |

回答下列问题:
(1)反应I的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,其中还原剂为C(填化学式),该反应涉及的副反应可能有(碳不足)C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑和(碳足量)3C+SiO2$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
(2)经反应Ⅱ所得的四氯化硅粗品中所含的物质如表:
| 组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
| 质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
| 沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
 .
.(3)已知反应Ⅳ的化学方程式为3SiCl4+4NH3$\frac{\underline{\;1400℃\;}}{\;}$Si3N4+12HCl,则反应Ⅲ和Ⅳ中尾气的用途为制取盐酸.若向一2L恒容密闭容器中投入1mol SiC14和1mol NH3,6min后反应完全,则0~6min内,HCl的平均反应速率为0.25 mol•L-l•min-l.