题目内容
11.同温同压下,分别用等质量的H2、CO、CO2、NH3四种气体吹起四个气球,其中由H2吹起的是( )| A. |  | B. |  | C. |  | D. |  |
分析 等质量的H2、CO、CO2、NH3四种气体的物质的量与其摩尔质量成反比,即摩尔质量越大,则物质的量越小,在同温同压下,体积越小,据此解答.
解答 解:气体的物质的量n=$\frac{m}{M}$,在同温同压下,气体摩尔体积相同,气体的体积V=n•Vm,即V=$\frac{m}{M}$Vm可知,摩尔质量越大,体积越小,
H2、CO、CO2、NH3的摩尔质量分别为2g/mol、28g/mol、44g/mol、17g/mol,H2的摩尔质量最小,其体积最大,则选项C是由H2吹起的,
故选C.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与气体摩尔体积、摩尔质量之间关系即可解答,试题侧重基础知识的考查,培养了学生的化学计算能力.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
1.Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”. S2O32-和Cl2反应的产物之一为SO42-.下列说法中,不正确的是( )
| A. | 上述反应中,每生成1mol SO42-,可脱去2mol Cl2 | |
| B. | 该反应中氧化剂是Cl2,反应消耗的氧化剂与还原剂之比为4:1 | |
| C. | 根据该反应可判断还原性:S2O32->Cl- | |
| D. | SO2也有漂白性,将SO2与氯气混合后使用,漂白性会增强 |
19.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,33.6L HF中含有氟原子的数目为1.5NA | |
| B. | 常温下,2.7g金属铝与足量浓度为18.4mol/L的浓H2SO4反应时转移的电子数为0.3NA | |
| C. | Na2O与Na2O2的混合物共1mol,阴离子数目为NA | |
| D. | CH4与P4的分子结构都是正四面体,每1mol CH4分子与P4分子都含有4NA个共价键 |
16.光纤通讯是光导纤维传送信号的一种通讯手段,合成光导纤维及氮化硅(一种无机涂层)的工艺流程如图:

回答下列问题:
(1)反应I的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,其中还原剂为C(填化学式),该反应涉及的副反应可能有(碳不足)C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑和(碳足量)3C+SiO2$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
(2)经反应Ⅱ所得的四氯化硅粗品中所含的物质如表:
图中“操作X”的名称为精馏(或蒸馏或分馏);PCl3的电子式为 .
.
(3)已知反应Ⅳ的化学方程式为3SiCl4+4NH3$\frac{\underline{\;1400℃\;}}{\;}$Si3N4+12HCl,则反应Ⅲ和Ⅳ中尾气的用途为制取盐酸.若向一2L恒容密闭容器中投入1mol SiC14和1mol NH3,6min后反应完全,则0~6min内,HCl的平均反应速率为0.25 mol•L-l•min-l.

回答下列问题:
(1)反应I的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,其中还原剂为C(填化学式),该反应涉及的副反应可能有(碳不足)C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑和(碳足量)3C+SiO2$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
(2)经反应Ⅱ所得的四氯化硅粗品中所含的物质如表:
| 组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
| 质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
| 沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
 .
.(3)已知反应Ⅳ的化学方程式为3SiCl4+4NH3$\frac{\underline{\;1400℃\;}}{\;}$Si3N4+12HCl,则反应Ⅲ和Ⅳ中尾气的用途为制取盐酸.若向一2L恒容密闭容器中投入1mol SiC14和1mol NH3,6min后反应完全,则0~6min内,HCl的平均反应速率为0.25 mol•L-l•min-l.
3.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1L 0.1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 4.6g Na在空气中完全反应生成Na2O、Na2O2,转移0.2 NA个电子 | |
| C. | 标准状况下,将22.4L Cl2通入水中发生反应,转移的电子数为NA | |
| D. | 100g 46%的乙醇溶液中,含H-O键的数目为NA |
20.设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 12g石墨烯(  )中含有C-C键的数目为1.5NA )中含有C-C键的数目为1.5NA | |
| B. | 100g质量分数为17%的H2O2水溶液中含氧原子数目为0.5NA | |
| C. | 常温下,1 L0.5 mol/L NH4Cl溶液与2 L0.25 mol/L NH4Cl溶液所含NH4+的数目均为0.5 NA | |
| D. | 在KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O反应中,每生成1 mol Cl2转移的电子数为2NA |
15.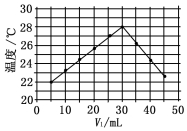 将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
 将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A. | 做该实验时环境温度为22℃ | |
| B. | 该实验表明可将热能转化为化学能 | |
| C. | NaOH溶液的浓度约为1.5 mol•L-1 | |
| D. | 该实验表明有水生成的反应都是放热反应 |
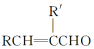 +H2O
+H2O ;E中含氧官能团的名称:羧基.
;E中含氧官能团的名称:羧基. +
+ $→_{加热}^{浓硫酸}$
$→_{加热}^{浓硫酸}$ +H2O.
+H2O.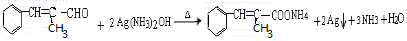 .
. .
.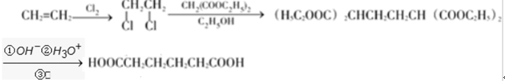 .
.