��Ŀ����
4��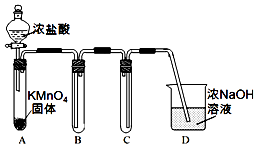 ij��ȤС����������������Ʒ������ȼ��仯�������̽����
ij��ȤС����������������Ʒ������ȼ��仯�������̽����I���ø�����غ�Ũ���ᷴӦ��ȡ����
��1����С��������ͼװ�ü��Լ��Ʊ����ռ�����Cl2��װ��B���ռ���������������������HCl��H2O��g����D������������C���ݳ���Cl2��
��2���Ƶõ������м�������ˮ���õ�������ˮ��
������ˮ�к���Ԫ�ص�����Cl-��Cl2��ClO-��HClO��д��ȫ�����Ļ�ѧʽ����
��3��������ˮ��ʯ��ʯ�ķ�Ӧ����ȡ��ŨHC1O��Һ�ķ���֮һ���ڹ�����ʯ��ʯ�м��뱥����ˮ��ַ�Ӧ�����������ݲ�������Һdz����ɫ��ȥ�����ˣ��õ�����Һ��Ư���Աȱ�����ˮ��ǿ��
����ҺƯ������ǿ��ԭ������ˮ�д���ƽ��Cl2+H2O?H++Cl-+HClO��CaCO3�����ᷴӦ��ƽ�������ƶ���������HClO��Ũ�ȣ�Ư��Ч����ǿ���û�ѧƽ���ƶ�ԭ�����ͣ���
����֪H2CO3�ĵڶ����볣��K2=5.6��10-11��HClO�ĵ��볣��K=3.0��10-8��д��Cl2��Na2CO3��Һ�����ʵ���֮��1��1ǡ�÷�Ӧ�����ӷ���ʽCl2+H2O+CO32-=HCO3-+HClO+Cl-��
��ClO3-��Cl-��H+��Ӧ��̽��
��4��KClO3��KCl��������Է�Ӧ����С�������ϵ��ʵ���о���Ӧ�����Է�Ӧ��Ӱ�죬ʵ���¼�����ʵ���������½��У���
| �ձ���� | 1 | 2 | 3 | 4 |
| ����ر�����Һ | 1mL | V1mL | V2mL | V3mL |
| �Ȼ��ع��� | 1g | 1g | 1g | 1g |
| ˮ | 8mL | V4mL | 3mL | 0mL |
| ���ᣨ6mol/L�� | V5mL | 2mL | V6mL | 8mL |
| ���� | ������ | ��Һ��dz��ɫ | ��Һ�ʻ���ɫ������dz����ɫ���� |
���ձ�2��ˮ�����V4ӦΪ6 mL���ձ�4�е�������Һ�ʻ���ɫ�����ɻ���ɫ���壮
��5����С��ͬѧ�����ϵ�֪��������ع����Ũ������Ҳ������������ͬʱ�д���ClO2���ɣ�ClO2�е�Ϊ10�棬�۵�Ϊ-59�棬Һ��Ϊ��ɫ��Cl2�е�Ϊ-34�棬Һ̬Ϊ����ɫ��������ʵ����֤Cl2�к���ClO2�ռ�һ�Թ����壬���Ͻ����������ˮ������У��۲�Һ�壨�����壩��ɫ�仯��
���� I����1�������ӷ��������������л���HCl��ˮ�����������ж�����Ҫ��β��������
��2������Cl2+H2O?H++Cl-+HClO��HClO?H++ClO-������
��3����CaCO3�����ᷴӦ������H+��Ũ�ȣ�����Cl2+H2O?H++Cl-+HClOƽ�������ƶ���
���ɵ��볣����֪HClO�����Դ���HCO3-������Cl2��Na2CO3��Һ�����ʵ���֮��1��1ʱCO32-��ΪHCO3-��
��4���ڱ���������Ӱ�컯ѧ��Ӧ���ʵ������Ƿ�Ӧ���Ũ�ȣ���������������ͬ����Ӧʱ�����ӵ�Ũ�Ȳ�ͬ����˷�Ӧʱ����ص�Ũ�ȱ�����ͬ��
����Һ�������ͬ��ͨ���ձ�4����Һ����ж��ձ�2��ˮ�����V4������������ͬʱ������Ũ��Խ��ѧ��Ӧ����Խ��
��5���������ʷе����ɫ�������ʵ�飮
��� �⣺I����1��2KMnO4+16HCl��Ũ���T2KCl+2MnCl2+5Cl2��+8H2O�������ӷ���������������HCl��H2O��g����Cl2�ж����ܱ�ŨNaOH��Һ���գ�װ��D��������C���ݳ���Cl2��
�ʴ�Ϊ��HCl��H2O��g��������C���ݳ���Cl2��
��2����������ˮ�γɱ�����ˮ�������漰Cl2+H2O?H++Cl-+HClO��HClO?H++ClO-�����ݿ��淴Ӧ���ܽ��е��ף����Ա�����ˮ�к���Ԫ�ص�����Cl-��Cl2��ClO-��HClO��
�ʴ�Ϊ��Cl-��Cl2��ClO-��HClO��
��3������ˮ�д���ƽ��Cl2+H2O?H++Cl-+HClO��CaCO3�����ᷴӦ������H+��Ũ�ȣ�ƽ�������ƶ�������HClO��Ũ������Ư��Ч����ǿ��
�ʴ�Ϊ����ˮ�д���ƽ��Cl2+H2O?H++Cl-+HClO��CaCO3�����ᷴӦ��ƽ�������ƶ���������HClO��Ũ�ȣ�Ư��Ч����ǿ��
����֪H2CO3�ĵڶ����볣��K2=5.6��10-11��HClO�ĵ��볣��K=3.0��10-8��˵��HClO�����Դ���HCO3-������Cl2��Na2CO3��Һ�����ʵ���֮��1��1ʱCO32-��ΪHCO3-�����ӷ���ʽΪCl2+H2O+CO32-=HCO3-+HClO+Cl-��
�ʴ�Ϊ��Cl2+H2O+CO32-=HCO3-+HClO+Cl-��
��4���ٱ���������Ӱ�컯ѧ��Ӧ���ʵ������Ƿ�Ӧ���Ũ�ȣ���������������ͬ����Ӧʱ�����ӵ�Ũ�Ȳ�ͬ����˷�Ӧʱ����ص�Ũ�ȱ�����ͬ����V1mL=V2mL=V3mL=1mL����˸�ϵ��ʵ���Ŀ��������������ͬ�������ӻ�������Ũ�Ȳ�ͬ�Ի�ѧ��Ӧ���ʵ�Ӱ�죬
�ʴ�Ϊ������������ͬ�������ӻ�������Ũ�Ȳ�ͬ�Ի�ѧ��Ӧ���ʵ�Ӱ�죻
������ʵ������Һ�������ͬ���ձ�4����Һ���Ϊ1mL+8mL=9mL������V1mL+V4mL+2mL=9mL��V4=6ml��
�ձ�4�м���6mol/L������Һ������Ӧʱ������Ũ�����ѧ��Ӧ������죬�����3���ձ��и�Ϊ���ԣ���������Ϊ��Һ�ʻ���ɫ�����ɻ���ɫ���壬
�ʴ�Ϊ��6����Һ�ʻ���ɫ�����ɻ���ɫ���壻
��5������ClO2�е�Ϊ10�棬�۵�Ϊ-59�棬Һ��Ϊ��ɫ��Cl2�е�Ϊ-34�棬Һ̬Ϊ����ɫ��Ϊ��֤Cl2�к���ClO2���ռ�һ�Թ����壬���Ͻ����������ˮ������У��۲�Һ�壨�����壩��ɫ�仯�������ֺ�ɫ����˵��Cl2�к���ClO2��
�ʴ�Ϊ���ռ�һ�Թ����壬���Ͻ����������ˮ������У��۲�Һ�壨�����壩��ɫ�仯��
���� ���⿼��������ʵ�����Ʒ����й����ʣ��漰��ѧƽ���ƶ�ԭ����Ӧ�ú���������Ի�ѧ��Ӧ����Ӱ���̽���ķ������ۺ��Խ�ǿ����Ŀ�Ѷ��еȣ����л�ѧƽ�ⳣ����Ӧ��Ϊ�����״��㣮

| A�� | $\frac{2b-c}{a}$ | B�� | $\frac{2b-c}{2a}$ | C�� | $\frac{2b-c}{3a}$ | D�� | $\frac{2b-c}{6}$ |
| X | Y | Z | T | |
| L |
| A�� | ԭ�Ӱ뾶��X��Y��Z��T��L | |
| B�� | ��̬�⻯��Ļ�ԭ�ԣ�L��Z��T | |
| C�� | ��x����������Һ��Ͽ������ɳ��� | |
| D�� | Y�ĺ����������С��T�ĺ����� |
| A�� | ��״���£�33.6L HF�к��з�ԭ�ӵ���ĿΪ1.5NA | |
| B�� | �����£�2.7g������������Ũ��Ϊ18.4mol/L��ŨH2SO4��Ӧʱת�Ƶĵ�����Ϊ0.3NA | |
| C�� | Na2O��Na2O2�Ļ���ﹲ1mol����������ĿΪNA | |
| D�� | CH4��P4�ķ��ӽṹ�����������壬ÿ1mol CH4������P4���Ӷ�����4NA�����ۼ� |
| A�� | ��������Һ�ܲ��������ЧӦ | B�� | �������ֿ�����ʳƷ�ķ������� | ||
| C�� | ҽ�þƾ�����������ˮ���� | D�� | ���ۡ���֬�������ʿ��ṩӪ�� |

�ش��������⣺
��1����ӦI�Ļ�ѧ����ʽΪ2C+SiO2$\frac{\underline{\;����\;}}{\;}$Si+2CO�������л�ԭ��ΪC���ѧʽ�����÷�Ӧ�漰�ĸ���Ӧ�����У�̼���㣩C+SiO2$\frac{\underline{\;����\;}}{\;}$Si+CO2���ͣ�̼������3C+SiO2$\frac{\underline{\;����\;}}{\;}$SiC+2CO����
��2������Ӧ�����õ����Ȼ����Ʒ�����������������
| ������� | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
| �������� | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
| �е�/�� | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
 ��
����3����֪��Ӧ���Ļ�ѧ����ʽΪ3SiCl4+4NH3$\frac{\underline{\;1400��\;}}{\;}$Si3N4+12HCl����Ӧ��͢���β������;Ϊ��ȡ���ᣮ����һ2L�����ܱ�������Ͷ��1mol SiC14��1mol NH3��6min��Ӧ��ȫ����0��6min�ڣ�HCl��ƽ����Ӧ����Ϊ0.25 mol•L-l•min-l��
| A�� | ԭ�Ӱ뾶��X��Y��Z��W | |
| B�� | X��Y��Z����Ԫ�ص�����������ˮ��������֮�������Ӧ | |
| C�� | X��Y��Ӧ���Ȼ��ﶼ�����Ӿ��� | |
| D�� | W������⻯��е��Z�ĸ� |
| A�� | ��������C | B�� | �����ݻ�����Сѹǿ | ||
| C�� | ��С�ݻ�������ѹǿ | D�� | �ݻ����䣬���롰�衱�� |