题目内容
5.在恒温恒容的密闭容器中,充入4mol气体A和2mol气体B发生反应:3A(g)+2B(g)?4C(?)+2D(?).反应一段时间后达到平衡,测得生成1.6mol C,反应前后体系压强之比为5:4.则下列说法正确的是( )| A. | 气体A的平衡转化率大于气体B的平衡转化率 | |
| B. | 物质D的聚集状态一定是气体 | |
| C. | 平衡后升高温度,若平衡向左移动,则正反应的△H>0 | |
| D. | 平衡后若减小该体系的压强,则平衡向左移动,化学平衡常数增大 |
分析 恒容容器中,气体的压强之比等于气体的物质的量之比,从反应物和生成物的化学计量数和反应前后压强之比可知,C和D中至少有一种物质不是气体,利用三段式法计算出反应后气体物质的量,确定C、D的状态,
A.充入4mol气体A和2mol气体B发生反应,可以看做先充入3molA和2molB反应达到衡,再加入1molA平衡正向进行,两种反应物增加一种会提高另一种的转化率;
B.物质D的聚集状态一定是气体;
C.升温平衡向吸热反应方向进行;
D.化学平衡常数只受温度的影响,不受压强影响.
解答 解:反应方程式为:3A(g)+2B(g)?4C(?)+2D(?)
反应前(mol) 4 2 0 0
反应消耗(mol) 1.2 0.8 1.6 0.8
平衡后(mol) 2.8 1.2 1.6 0.8
反应前后体系压强之比为5:4,根据气体物质的量之比等于压强之比可知反应后气体物质的量为:$\frac{4}{5}$×(4+2)mol=4.8mol,所以C、D都必须为气态,
A.充入4mol气体A和2mol气体B发生反应,可以看做先充入3molA和2molB反应达到衡,再加入1molA平衡正向进行,A的转化率减小,B转化率增大,故A错误;
B.根据计算分析可知,物质D的聚集状态一定是气体,故B正确;
C.平衡后升高温度,若平衡向左移动,逆反应为吸热反应,则正反应为放热反应,反应的△H<0,故C错误;
D.平衡后若减小该体系的压强,则平衡向左移动,但化学平衡常数不变,故D错误;
故选B.
点评 本题考查较为综合,涉及平衡计算、转化率、平衡常数的影响因素等知识,题目难度中等,注意掌握化学平衡及其影响因素,气体压强之比等于气体物质的量之比计算分析CD的状态是解题关键,试题培养了学生的分析能力及灵活应用能力.

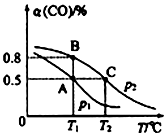
在10L的密闭容器中按物质的量之比1:2充入CO和H2,若充有10molCO发生反应:CO(g)+2H2(g)?CH3OH(g).
测得平衡时CO的转化率隨温度变化及压强的变化如图所示:
p2、T2时,n(CO)随时间的变化如表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(CO)/mol | 10 | 7 | 5 | 5 |
(2)你认为p1<p2(填“<”“>”或“=”)
(3)合成甲醇的反应为放热(填“放热”或“吸热”)反应.A、B、C三点的平衡常数KA、KB、KC的大小关系为Ka=Kb>Kc.
(4)若工业生产CH3OH,下列措施中,能增加单位时间内CH3OH产量的方法有①③④⑤⑥.
①增大压强 ②降低温度 ③升高温度
④加入催化剂 ⑤适当增大一氧化碳的比例量 ⑥及时分离CH3OH
(5)己知碳的燃烧热为Q1kJ/mol,碳与氧气反应生成一氧化碳(按量筒整数比)的反应热为-Q2J/mol,则二氧化碳在二硒化钨作催化剂时分解的热化学方程式(按最简整数比)为:2CO2(g)=2CO(g)+O2(g)△H=+2(Q1-Q2)kJ/mol.
| A. | 大于32.8% | B. | 小于32.8% | C. | 等于32.8% | D. | 约等于32.8% |
 一定温度下,将1mol A和1mol B气体充入2L密闭容器,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )
一定温度下,将1mol A和1mol B气体充入2L密闭容器,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确是( )| A. | 该反应方程式中的x=l | |
| B. | 0~t1时,用A表示的反应速率υ(A)=0.50mol/(L•min) | |
| C. | t2和t3时,改变的条件分别是加入催化剂和移去少量物质D | |
| D. | t1~t3间,该反应的平衡常数均为4 |
| A. | 已知:Ⅰ:对于反应:H2(g)+Cl2(s)═2HCl (g)△H=-a kJ/mol, Ⅱ:  且a、b、c均大于零,则断开1molH-Cl键所需的能量为-a-b-c | |
| B. | 若2C(s)+O2(g)═2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 如图可表示水分解过程中的能量变化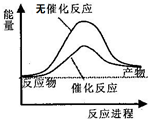 |
(1)反应C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量 B.升高温度
C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则反应 CO(g)+H2O(g)?CO2(g)+H2(g) 的△H=-41.2kJ•mol-1.
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②其它条件不变,再充入0.1mol CO(g)和0.1mol H2O(g),达到平衡时CO的体积分数不变(填“增大”、“减小”或“不变”).
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2 | |
| C. | S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2 | |
| D. | 2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2 |
| A. | 1.0g | B. | 2.0g | C. | 2.5g | D. | 3.5g |
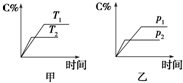 可逆反应A(?)+aB(g)?C(g)+D(g),其中a为正整数.反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.试回答下列问题:
可逆反应A(?)+aB(g)?C(g)+D(g),其中a为正整数.反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.试回答下列问题: