题目内容
16.某一反应物在一定条件下的平衡转化率为32.8%,当使用了催化剂时,其转化率为( )| A. | 大于32.8% | B. | 小于32.8% | C. | 等于32.8% | D. | 约等于32.8% |
分析 根据使用催化剂,只改变反应速率、化学平衡不移动来分析.
解答 解:某一反应在一定条件下的平衡转化率为32.8%,其他条件不变,有一催化剂存在时,催化剂改变反应速率,不能改变化学平衡,其转化率不变为32.8%;
故选C.
点评 本题考查了化学平衡影响因素分析判断,催化剂改变反应速率不改变化学平衡状态,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.工业上用某矿渣(主要成分是Cu2O,少量杂质是Al2O3、Fe2O3和SiO2)提取铜的操作流程如下:
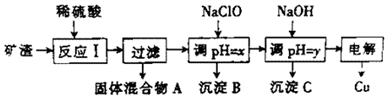
已知:①Cu2O+2H+═Cu+Cu2++H2O ②某些金属氢氧化物开始测沉淀和完全沉淀时的pH
(1)反应I中,与铁元素有关反应的离子方程式为Fe2O3+6H+═2Fe3++3H2O、2Fe3++Cu═2Fe2++Cu2+.
(2)y的数值范围是5.2≤pH<5.4.
(3)以上步骤中的NaOH可以用AC代替(填字母)
A.CuO B.NH4Cl C.Cu(OH)2
(4)电解过程中,阳极产物可能为Cl2、O2.
(5)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,且该物质与还原产物的物质的量之比为4:1,该反应的离子方程式为2Fe2++5ClO-+5H2O=2Fe(OH)3+Cl-+4HClO.

已知:①Cu2O+2H+═Cu+Cu2++H2O ②某些金属氢氧化物开始测沉淀和完全沉淀时的pH
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 2.2 | 5.8 |
| 沉淀完成pH | 6.7 | 5.2 | 3.2 | 8.8 |
(2)y的数值范围是5.2≤pH<5.4.
(3)以上步骤中的NaOH可以用AC代替(填字母)
A.CuO B.NH4Cl C.Cu(OH)2
(4)电解过程中,阳极产物可能为Cl2、O2.
(5)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,且该物质与还原产物的物质的量之比为4:1,该反应的离子方程式为2Fe2++5ClO-+5H2O=2Fe(OH)3+Cl-+4HClO.
4.向密闭容器中充入1.0mol CO和2.0mol H2O(g)发生反应:CO+H2O(g)?CO2+H2.当反应达平衡时,CO的转化率为α.若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达平衡时CO的转化率小于α的是( )
| A. | 0.5molCO+2.0molH2O(g)+1.0molCO2+1.0mol H2 | |
| B. | 1.0molCO+2.0molH2O(g)+0.5molHe | |
| C. | 1.0molCO+1.0molH2O(g)+1.0molCO2+1.0mol H2 | |
| D. | 0.5molCO+1.5molH2O(g)+0.4molCO2+0.4mol H2 |
5.在恒温恒容的密闭容器中,充入4mol气体A和2mol气体B发生反应:3A(g)+2B(g)?4C(?)+2D(?).反应一段时间后达到平衡,测得生成1.6mol C,反应前后体系压强之比为5:4.则下列说法正确的是( )
| A. | 气体A的平衡转化率大于气体B的平衡转化率 | |
| B. | 物质D的聚集状态一定是气体 | |
| C. | 平衡后升高温度,若平衡向左移动,则正反应的△H>0 | |
| D. | 平衡后若减小该体系的压强,则平衡向左移动,化学平衡常数增大 |
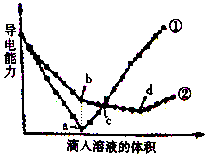 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴人溶液体积变化的曲线如图所示.
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴人溶液体积变化的曲线如图所示.

 已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验: