题目内容
11.化学实验要符合“绿色化学”理念.某实验小组对“铜与浓硝酸反应”进行了探究性实验.试回答下列问题: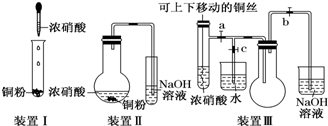
(1)写出铜和浓硝酸反应的离子方程式:Cu+4H++2NO3-═Cu2++2H2O+NO2↑
(2)与装置Ⅰ相比,装置Ⅱ的优点是无氮的氧化物逸出,可避免环境污染,装置Ⅲ除具有装置Ⅱ的优点外,还具有的优点是可使反应随时进行,随时停止.
(3)在装置Ⅲ中,若使NO2气体充满烧瓶,应先关闭弹簧夹c,再打开弹簧夹ab;当气体充满烧瓶后,将铜丝提起,然后把a、b、c都关闭,并把烧瓶置于沸水中,下列情况不变的是BD.
A.颜色 B.质量 C.气体的平均相对分子质量 D.密度 E.压强
(4)为了验证NO2与水的反应,欲使烧杯中的水进入烧瓶的操作是关闭a和c,打开b,对烧瓶进行水浴加热,待气体不再放出时关闭b,停止加热,打开c.
分析 (1)铜和足量浓硝酸反应生成硝酸铜和二氧化氮和水;
(2)对生成的氮氧化物吸收防止污染空气,装置Ⅲ无污染,随时进行和停止;
(3)在装置Ⅲ中,若使NO2气体充满烧瓶应关闭c,打开ab,过量二氧化氮可以被氢氧化钠溶液吸收;
根据此步骤是为了NO2气体充满②试管;根据存在反应2NO2?N2O4是化学平衡,结合平衡移动原理分析;
(4)验证NO2与水的反应,欲使烧杯中的水进入烧瓶,需要让二氧化氮与水接触发生反应.
解答 解:(1)铜和足量浓硝酸反应的离子方程式为:Cu+4H++2NO3-═Cu2++2H2O+NO2↑;
故答案为:Cu+4H++2NO3-═Cu2++2H2O+NO2↑;
(2)乙装置能吸收NO2气体,所以无氮的氧化物逸出,可避免环境污染;C装置能控制反应,可使反应随时进行,随时停止,
故答案为:无氮的氧化物逸出,可避免环境污染;可使反应随时进行,随时停止;
(3)为了NO2气体充满②试管,应先关闭c,然后打开a、b,
在25度时试管中的二氧化氮会转化为四氧化二氮,2NO2(g)?N2O4(g)(正反应为放热反应),若把试管置于100度的沸水中.
A.由于该反应是放热反应,置于100℃的沸水中,平衡会逆向移动,NO2增多,那么颜色会变深,故A错误;
B.根据质量守恒定律知,二氧化氮转化前后,物质的总质量不变,故B正确;
C.二氧化氮转化前后,气体的总质量不变,物质的量改变,所以平均摩尔质量改变,故C错误;
D.根据质量守恒定律知,二氧化氮转化前后,物质的总质量不变,试管的容积不变,所以气体的密度始终不变,故D正确;
E.二氧化氮转化前后,气体的物质的量改变,所以压强改变,故E错误;
故答案:c;ab;BD.
(4)为了让二氧化氮与水接触发生反,关闭a和c,打开b,对烧瓶进行水浴加热,待气体不再放出时关闭b,停止加热,打开c,
故答案为:关闭a和c,打开b,对烧瓶进行水浴加热,待气体不再放出时关闭b,停止加热,打开c.
点评 本题考查了氮氧化合物的性质等知识点,难度中等,易错题是(3)题,容易忽略二氧化氮和四氧化二氮之间的转化,温度对该反应的影响,错误的认为二氧化氮和沸水反应生成硝酸和一氧化氮,导致选择错误.

| A. | pH=1的无色溶液中:SO42ˉ、Cu2+、Na+、Clˉ | |
| B. | 中性溶液中:Fe3+、Al3+、NO3ˉ、Clˉ | |
| C. | 能使石蕊试纸变蓝色的溶液中:Na+、K+、S2ˉ、CO32ˉ | |
| D. | 水电离出的c(H+)=1×10ˉ12mol•Lˉ1的溶液中:K+、Na+、Clˉ、HCO3ˉ |
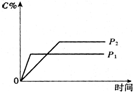 温度一定时,压强分别为P1,P2的条件下,A(g)+2B(g)?nC(g) 的反应体系中,C的分数与时间t,压强P1,P2的关系如图所示,则下列结论正确的是( )
温度一定时,压强分别为P1,P2的条件下,A(g)+2B(g)?nC(g) 的反应体系中,C的分数与时间t,压强P1,P2的关系如图所示,则下列结论正确的是( )| A. | P1>P2,n<3 | B. | P1<P2,n=3 | C. | P1<P2,n>3 | D. | P1>P2,n>3 |
| A. | CH3-CH2-OH | B. | CH3-CH2-CH2-OH | ||
| C. | HO-CH2-CH2-CH2-OH | D. |  |
| A. | NH3 | B. | HClO | C. | SO2 | D. | Na2O2 |
| A. | 用四氯化碳萃取 | B. | 用氢氧化钠溶液洗涤 | ||
| C. | 用碘化钾溶液洗涤 | D. | 用亚硫酸氢钠溶液洗涤 |
 .
.