题目内容
6.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如表:请回答:
| 实验编号 | HA物质的量浓度(mol•L1) | NaOH物质的量浓度(mol•Lˉ1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | a |
| 乙 | c1 | 0.2 | 7 |
| 丙 | 0.1 | 0.1 | 7 |
| 丁 | 0.1 | 0.1 | 9 |
(选填“是”或“否”);该混合溶液中离子浓度c(Aˉ)与c(Na+)的大小关系是C;
A.前者大 B.后者大 C.二者相等 D.无法判断
(2)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)=c(A-)=c(OH-)=c(H+);
(3)丁组实验所得混合溶液中,写出下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简).c(Na+)-c(Aˉ)=10-5-10-9 mol•Lˉ1.
分析 (1)根据电荷守恒及HA为弱酸、弱酸分析;
(2)反应后溶液为中性,则c(OH-)=c(H+),结合电荷守恒判断丙溶液中的离子浓度大小;
(3)等物质的量的酸碱反应后溶液呈碱性,溶液中氢氧根离子全部来自于弱酸根离子水解得到的,水电离出的氢离子等于水电离出的氢氧根离子,根据电荷守恒计算.
解答 解:(1)反应后溶液呈中性,如HA为强酸,则c=0.2,如HA为弱酸,则c>0.2,仅从乙组情况分析,c不一定等于0.2,由于反应后溶液呈中性,则有c(OH-)=c(H+),根据溶液呈中性,则有c(Na+)+c(H+)=c(A-)+c(OH-),所以c(A-)=c(Na+),故选C;
故答案为:否;C;
(2)由于丙中反应后溶液呈中性,则c(OH-)=c(H+),根据电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-)可知:c(A-)=c(Na+),溶液中离子浓度大小为:c(Na+)=c(A-)=c(OH-)=c(H+),
故答案为:c(Na+)=c(A-)=c(OH-)=c(H+);
(3)溶液的pH=9,则氢离子浓度为10-9 mol/L,等物质的量的酸碱反应后溶液呈碱性,溶液中氢氧根离子全部来自于弱酸根离子水解得到的,c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-9}}$=mol/L=10-5 mol/L,水电离出的氢离子浓度等于溶液中氢氧根离子浓度为10-5mol/L,根据电荷守恒得:c (Na+)+c (H+)=c (A-)+c (OH-),所以c (Na+)-c (A-)=c (OH-)-c (H+)=[10-5-10-9]mol/L,
故答案为:10-5-10-9.
点评 本题考查酸碱混合的判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握溶液pH的概念及计算方法,能够根据盐的水解原理、电荷守恒、物料守恒等知识判断离子浓度大小.

| A. | 容量瓶:500mL、250mL各一个;CuSO4:共120g | |
| B. | 容量瓶:750mL;CuSO4:120g | |
| C. | 容量瓶:1000mL;CuSO4•5H2O:160g | |
| D. | 容量瓶:1000mL;CuSO4:160g |
| A. | 合成纤维和光导纤维都属于新型无机非金属材料 | |
| B. | “地沟油”禁止食用,但经过加T处理后,可以用来制取肥皂和生物柴油 | |
| C. | 大力推广应用“脱硫、脱硝”技术,可减少硫氧化物、氮氧化物对空气的污染 | |
| D. | 2015年10月我国科学家屠呦呦获诺贝尔医学、生理学奖,她发现、创制的药物青篙素( )是治疗疟疾的特效药,青篙素的分子式为C15H22O5 )是治疗疟疾的特效药,青篙素的分子式为C15H22O5 |
| A. | C2H6 | B. | C2H4 | C. | C2H2 | D. | C2H6O |
| A. | pH=1的无色溶液中:SO42ˉ、Cu2+、Na+、Clˉ | |
| B. | 中性溶液中:Fe3+、Al3+、NO3ˉ、Clˉ | |
| C. | 能使石蕊试纸变蓝色的溶液中:Na+、K+、S2ˉ、CO32ˉ | |
| D. | 水电离出的c(H+)=1×10ˉ12mol•Lˉ1的溶液中:K+、Na+、Clˉ、HCO3ˉ |

| A. | 石墨烯、石墨炔和石墨烷互为同素异形体 | |
| B. | 12g石墨烯完全转变为石墨烷需氢气11.2L | |
| C. | 石墨炔可作半导体材料,有望替代二氧化硅 | |
| D. | 石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜 |
| A. | NH3 | B. | HClO | C. | SO2 | D. | Na2O2 |
 ,碳元素的化合价为+2;用ClO2处理泄漏的氰化钠,得到无毒的NaCl、N2和CO2.若处理4×10-5mol•L-1的废水1000L,至少需要ClO2的质量为2.7g.
,碳元素的化合价为+2;用ClO2处理泄漏的氰化钠,得到无毒的NaCl、N2和CO2.若处理4×10-5mol•L-1的废水1000L,至少需要ClO2的质量为2.7g. 已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素原子序数为29.
已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素原子序数为29.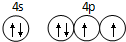 .
.