题目内容
1.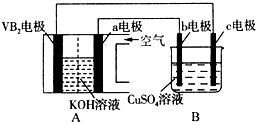 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )| A. | 电解过程中,c电极表面先有红色物质析出,然后有气泡产生 | |
| B. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| C. | 外电路中电子由c电极流向VB2电极 | |
| D. | 若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.1 mol/L |
分析 硼化钒-空气燃料电池中,VB2在负极失电子,氧气在正极上得电子,电池总反应为:4VB2+11O2═4B2O3+2V2O5,则与负极相连的c为电解池的阴极,铜离子得电子发生还原反应,与氧气相连的b为阳极,氢氧根失电子发生氧化反应,以此解答该题.
解答 解:A.电解过程中,c为阴极,发生还原反应,先生成铜,后生成氢气,故A正确;
B.负极上是VB2失电子发生氧化反应,则VB2极发生的电极反应为:2VB2+22OH--22e-=V2O5+2B2O3+11H2O,故B错误;
C.外电路中电子由VB2电极流向阴极c电极,故C错误;
D.外电路中通过0.04mol电子时,B装置内与氧气相连的b为阳极,氢氧根失电子生成氧气为0.01mol,又共收集到0.448L气体即$\frac{0.448L}{22.4L/mol}$=0.02mol,则阴极也产生0.01moL的氢气,所以溶液中的铜离子为$\frac{0.04-0.01×2}{2}$=0.01mol,则CuSO4溶液的物质的量浓度为$\frac{0.01}{0.2}$=0.01mol/L,故D错误.
故选A.
点评 本题考查原电池及其电解池的工作原理,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,本题注意把握电极反应式的书写,利用电子守恒计算.

练习册系列答案
相关题目
11.石墨烯可看作将石墨的层状结构一层一层地剥开得到的单层碳原子;石墨炔是平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能;将氢气氢化到石墨烯排列的六角晶格中,使每个碳原子都 增加一个氢原子可得最薄的绝缘新材料石墨烷.下列有关说法中正确的是( )
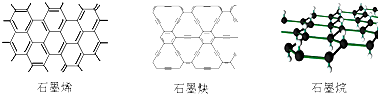

| A. | 石墨烯、石墨炔和石墨烷互为同素异形体 | |
| B. | 12g石墨烯完全转变为石墨烷需氢气11.2L | |
| C. | 石墨炔可作半导体材料,有望替代二氧化硅 | |
| D. | 石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜 |
12.用碳棒电极电解一定质量的某浓度的氯化钾溶液,一段时间后停止电解.此时若加入100g 36.5%的浓盐酸,所得溶液正好与原溶液完全相同,则电解过程中转移电子的物质的量约为( )
| A. | 9 mol | B. | 7 mol | C. | 6 mol | D. | 8 mol |
9.强电解质甲、乙、丙、丁分别溶于水,电离出NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-(每种溶液中溶质电离出的离子各不相同).已知:①甲溶液分别与其它三种溶液混合,均产生白色沉淀;②0.1mol•L-1乙溶液中c(H+)>0.1mol•L-1;③向丙溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀.下列结论不正确的是( )
| A. | 四种物质中一定有共价化合物 | B. | 四种物质中一定有Ba(OH)2 | ||
| C. | 丙溶液加热蒸干可得原无水溶质 | D. | 丁溶液中含有HCO3- |
16.下列物质的水溶液不具有漂白性的是( )
| A. | NH3 | B. | HClO | C. | SO2 | D. | Na2O2 |
6.下列不能使有色布条褪色的物质是( )
| A. | 漂白粉溶液 | B. | 次氯酸钠溶液 | C. | 氯化钙溶液 | D. | 二氧化硫 |
10.已知热化学方程式:
H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+241.8kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H=-285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是( )
H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+241.8kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H=-285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是( )
| A. | 吸热44kJ | B. | 吸热2.44KJ | C. | 放热44kJ | D. | 放热2.44KJ |