题目内容
7.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 1 molAl3+离子含有的核外电子数为3NA | |
| B. | 1.7gH2O2中含有的电子数为0.9NA | |
| C. | 常温下,11.2L的甲烷气体含有甲烷分子数为0.5NA个 | |
| D. | 标准状况下,33.6LH2O含有9.03×1023个H2O分子 |
分析 A.1 个Al3+离子含有10个电子;
B.根据n=$\frac{m}{M}$计算1.7gH2O2的物质的量,每个H2O2分子含有18个电子,据此计算电子物质的量,再根据N=nNA计算电子数目;
C.常温下,Vm≠22.4L/mol;
D.标准状况水时为液体.
解答 解:A.1 molAl3+离子含有的核外电子数为10NA,故A错误;
B.1.7gH2O2的物质的量为$\frac{1.7g}{34g/mol}$=0.05mol,每个H2O2分子含有18个电子,电子物质的量为0.05mol×18=0.9mol,故含有电子数目为0.9mol×NAmol-1=0.9NA,故B正确;
C.常温下,Vm≠22.4L/mol,11.2L的甲烷的物质的量无法求出,故C错误;
D.标准状况水时为液体,33.6LH2O不是1.5mol,故D错误.
故选B.
点评 本题考查阿伏加德罗常数的有关计算,难度不大,注意气体摩尔体积的使用条件与现象.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
17.化学与生产、生活密切相关,下列说法不正确的是( )
| A. | 合成纤维和光导纤维都属于新型无机非金属材料 | |
| B. | “地沟油”禁止食用,但经过加T处理后,可以用来制取肥皂和生物柴油 | |
| C. | 大力推广应用“脱硫、脱硝”技术,可减少硫氧化物、氮氧化物对空气的污染 | |
| D. | 2015年10月我国科学家屠呦呦获诺贝尔医学、生理学奖,她发现、创制的药物青篙素( )是治疗疟疾的特效药,青篙素的分子式为C15H22O5 )是治疗疟疾的特效药,青篙素的分子式为C15H22O5 |
12.用碳棒电极电解一定质量的某浓度的氯化钾溶液,一段时间后停止电解.此时若加入100g 36.5%的浓盐酸,所得溶液正好与原溶液完全相同,则电解过程中转移电子的物质的量约为( )
| A. | 9 mol | B. | 7 mol | C. | 6 mol | D. | 8 mol |
19.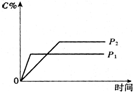 温度一定时,压强分别为P1,P2的条件下,A(g)+2B(g)?nC(g) 的反应体系中,C的分数与时间t,压强P1,P2的关系如图所示,则下列结论正确的是( )
温度一定时,压强分别为P1,P2的条件下,A(g)+2B(g)?nC(g) 的反应体系中,C的分数与时间t,压强P1,P2的关系如图所示,则下列结论正确的是( )
 温度一定时,压强分别为P1,P2的条件下,A(g)+2B(g)?nC(g) 的反应体系中,C的分数与时间t,压强P1,P2的关系如图所示,则下列结论正确的是( )
温度一定时,压强分别为P1,P2的条件下,A(g)+2B(g)?nC(g) 的反应体系中,C的分数与时间t,压强P1,P2的关系如图所示,则下列结论正确的是( )| A. | P1>P2,n<3 | B. | P1<P2,n=3 | C. | P1<P2,n>3 | D. | P1>P2,n>3 |
16.下列物质的水溶液不具有漂白性的是( )
| A. | NH3 | B. | HClO | C. | SO2 | D. | Na2O2 |
17.硅及其化合物在材料领域中应用广泛.下列叙述中,不正确的是( )
| A. | 晶体硅是良好的半导体材料 | |
| B. | 光导纤维中成分和沙子中的主要成分相同 | |
| C. | 用通入澄清石灰水的方法可以区分出CO2和SO2气体 | |
| D. | SO2的漂白原理与木炭、过氧化钠及湿润氯气的漂白原理不同 |
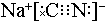 ,碳元素的化合价为+2;用ClO2处理泄漏的氰化钠,得到无毒的NaCl、N2和CO2.若处理4×10-5mol•L-1的废水1000L,至少需要ClO2的质量为2.7g.
,碳元素的化合价为+2;用ClO2处理泄漏的氰化钠,得到无毒的NaCl、N2和CO2.若处理4×10-5mol•L-1的废水1000L,至少需要ClO2的质量为2.7g.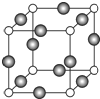 已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素原子序数为29.
已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素原子序数为29. .
.