题目内容
15.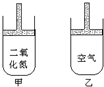 常温常压下在可移动活塞的甲、乙容器(如图)里分别充有等体积的二氧化氮(已建立了平衡:2NO2?N2O4;△H<0.)和空气,现分别进行下列两个实验:
常温常压下在可移动活塞的甲、乙容器(如图)里分别充有等体积的二氧化氮(已建立了平衡:2NO2?N2O4;△H<0.)和空气,现分别进行下列两个实验:①将两容器置于沸水中加热;②在活塞上都加2千克的砝码.
在以上两情况下,甲和乙容器中气体体积大小的比较,正确的是( )
| A. | ①甲>乙②甲>乙 | B. | ①甲>乙②甲<乙 | C. | ①甲<乙②甲>乙 | D. | ①甲>乙②甲=乙 |
分析 先先分析条件变化引起体积如何变化,再根据甲中存在平衡,乙不存在,分析平衡移动对体积的进一步影响,据此进行解答.
解答 解:实验①在沸水中,气体体积都受热膨胀,甲中存在平衡N2O4?2NO2 △H>0,升高温度,平衡正向移动,使体积进一步增大,所以容器体积:甲>乙;
实验②在活塞上都加2kg的砝码,压强增大,气体都缩小,甲中存在平衡N2O4?2NO2 △H>0,增大压强,平衡逆向移动,体积减小得更多,所以容器体积:甲<乙,
故选B.
点评 本题考查化学平衡的影响因素,题目难度中等,注意甲中存在平衡,乙不存在,从温度、压强对平衡移动的影响角度分析,试题培养了学生的灵活应用能力.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
16.下列配制溶液的操作中,不会影响所配溶液浓度大小的是…( )
| A. | 托盘两边各垫一张质量相等的纸片称取固体NaOH | |
| B. | 容量瓶内水分未干便注入了液体 | |
| C. | 洗涤刚才盛过溶质的烧杯的洗涤液没有转入容量瓶 | |
| D. | 定容后使溶液混匀,静止,发现凹液面低于刻度线,立即滴加蒸馏水至刻度线 |
3.已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,下列说法正确的是( )
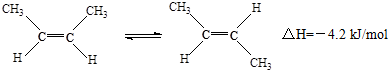

| A. | 顺-2-丁烯比反-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热比反-2-丁烯大 | |
| C. | 加压和降温有利于平衡向生成顺-2-丁烯反应方向移动 | |
| D. | 它们与氢气加成反应后的产物具有不同的沸点 |
4.在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),其平衡常数K和温度t的关系如下:
(1)K的表达式为:K=$\frac{c(CO).c({H}_{2}O)}{c(C{O}_{2}).c({H}_{2})}$;
(2)该反应的正反应为放热反应(“吸热”或“放热”);原因是升高温度平衡常数减小,平衡逆向移动
(3)能判断该反应是否已经达到化学平衡状态的是:D
A.混合气体总的物质的量不变 B.容器中压强不变
C.混合体系中平均摩尔质量不变 D.混合气体中CO浓度不变
(4)在850℃时,可逆反应:CO2(g)+H2(g)?CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
试计算:(要求写出简单的计算过程)
①前2min,CO2的平均反应速率;
②3min-4min达到平衡时CO的平衡浓度c3(c3精确到小数点后面三位数).
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(2)该反应的正反应为放热反应(“吸热”或“放热”);原因是升高温度平衡常数减小,平衡逆向移动
(3)能判断该反应是否已经达到化学平衡状态的是:D
A.混合气体总的物质的量不变 B.容器中压强不变
C.混合体系中平均摩尔质量不变 D.混合气体中CO浓度不变
(4)在850℃时,可逆反应:CO2(g)+H2(g)?CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O( mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
①前2min,CO2的平均反应速率;
②3min-4min达到平衡时CO的平衡浓度c3(c3精确到小数点后面三位数).
5.下列离子方程式书写正确的是( )
| A. | 硫酸溶液与氢氧化钡溶液:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| B. | 硫酸与氢氧化镁溶液:H++OH-═H2O | |
| C. | 碳酸钙与稀硝酸:CO32-+2H+═CO2↑+H2O | |
| D. | 铁与稀硫酸反应:Fe+2H+═Fe2++H2↑ |
 .
.