题目内容
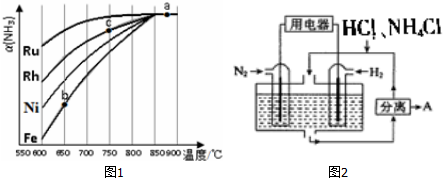
20.碳元素是形成物种最多的元素之一,其中许多物质对人类来说有着极其重要的作用.(1)石墨烯是一种由碳原子构成的单层片状结构的新材料,它是世上最薄却也是最坚硬的纳米材料,同时也是世界上导电性最好的材料(结构见图1).
试预测它与下列物质可能反应的是ABC.
A.氧气 B.单质氟 C.浓硝酸 D.氢氧化钠溶液
(2)①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=a kJ•mol-1;
②CH3OH(g)=CO(g)+2H2(g)△H=bkJ•mol-1;
CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=(a-b)kJ/mol.
(3)柠檬酸(H3Cit)是重要的三元有机酸,它的三种铵盐均易溶于水,它们可通过H3Cit与氨水反应获得,含碳各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系见图2.
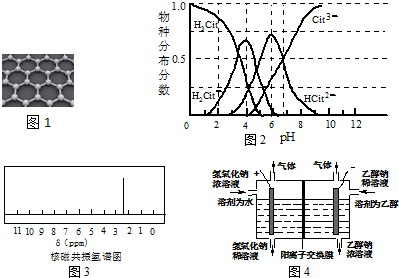
①为制取NH4H2Cit,pH应控制在大约4 或3.8~4.2;
②柠檬酸和一定量氨水反应所得溶液的pH约为6.7时,该反应的离子方程式为2H3Cit+5NH3•H2O=HCit2-+Cit3-+5NH4++5H2O或“2H3Cit+5NH3=HCit2-+Cit3-+5NH4+”.
(4)另一含碳化合物,其分子式为C3H6S2O,它是一种重要医药中间体,它的核磁共振氢谱见图3.则它的结构简式为
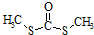 .
.(5)某科研组设计见图4装置,利用电解乙醇和氢氧化钠制取乙醇钠(阳离子交换膜只允许Na+通过).电解时阳极产成的气体是O2,阴极发生的电极反应式为2CH3CH2OH+2e-=2CH3CH2O-+H2↑.
分析 (1)碳和硅属于同族元素,两者性质相似,硅能和氧气、氟气、碱反应;
(2)先构建目标方程式,根据盖斯定律来计算化学反应的焓变,并书写热化学方程式;
(3)①制取NH4H2Cit的pH,可根据图示信息确定pH范围;
②溶液的pH约为6.7时,溶液中存在HCit2-、Cit3-等离子,据此结合电荷守恒、原子守恒书写离子方程式;
(4)另一含碳化合物,其分子式为C3H6S2O,根据核磁共振氢谱图知道该物质中含有一种类型的氢原子,完全对称结构,据此书写它的结构简式;
(5)在电解池的阳极上是阴离子失电子发生氧化反应的过程,阴极上得电子发生还原反应的过程.
解答 解:(1)硅能和氧气、氟气、碱反应,碳和硅属于同族元素,两者性质相似,所以碳单质的性质可以和氧气在点燃下反应,可以和浓硝酸加热下反应,碳单质可以和氟气之间反应,符合条件的为ABC,
故答案为:ABC;
(2)已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=a kJ•mol-1;
②CH3OH(g)═CO(g)+2H2(g)△H=bkJ•mol-1;
根据盖斯定律,反应CH4(g)+H2O(g)=CH3OH(g)+H2(g),可以是①-②得到,所以该反应的△H=(a-b)kJ/mol,热化学方程式为:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=(a-b)kJ/mol,
故答案为:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=(a-b)kJ/mol;
(3)①根据图示信息知道,H2Cit-存在的pH范围大约在4左右,大约4 或3.8~4.2,
故答案为:大约4 或3.8~4.2;
②根据图示信息知道:柠檬酸和一定量氨水反应所得溶液的pH约为6.7时,溶液中存在HCit2-、Cit3-等离子,所以反应的离子方程式为2H3Cit+5NH3•H2O=HCit2-+Cit3-+5NH4++5H2O或“2H3Cit+5NH3=HCit2-+Cit3-+5NH4+”,
故答案为:2H3Cit+5NH3•H2O=HCit2-+Cit3-+5NH4++5H2O或“2H3Cit+5NH3=HCit2-+Cit3-+5NH4+”;
(4)根据核磁共振氢谱图知道该物质中含有一种类型的氢原子,具有完全对称结构,它的结构简式为:(CH3S)2CO,即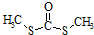 ,
,
故答案为: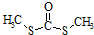 ;
;
(5)电解乙醇和氢氧化钠制取乙醇钠(阳离子交换膜只允许Na+通过),电解时阳极是氢氧离子失电子发生氧化反应的过程,产生氧气,阴极上是乙醇中的羟基氢原子得电子的还原反应,即2CH3CH2OH+2e-=2CH3CH2O-+H2↑,
故答案为:O2;2CH3CH2OH+2e-=2CH3CH2O-+H2↑.
点评 本题涉及碳单质的性质、电化学、热化学等方面的知识的考查,注意知识的归纳和梳理是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案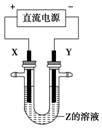 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )| A. | 氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 电镀工业中,X是待镀金属,Y是镀层金属 | |
| D. | 若Z是稀硫酸,X为铜,Y为铁,则铁不溶解,该方法为外加电流的阴极保护法 |
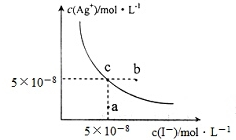
| A. | 在t℃时,Agl的Ksp=2.5×10-15 | |
| B. | 图中b点有碘化银晶体析出 | |
| C. | 向c点溶液中加入适量蒸馏水,可使溶液由c点到a点 | |
| D. | 在t℃时,反应AgBr(s)+I-(aq)?Agl(s)+Br-(aq)的平衡常数K=200 |
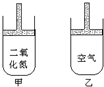 常温常压下在可移动活塞的甲、乙容器(如图)里分别充有等体积的二氧化氮(已建立了平衡:2NO2?N2O4;△H<0.)和空气,现分别进行下列两个实验:
常温常压下在可移动活塞的甲、乙容器(如图)里分别充有等体积的二氧化氮(已建立了平衡:2NO2?N2O4;△H<0.)和空气,现分别进行下列两个实验:①将两容器置于沸水中加热;②在活塞上都加2千克的砝码.
在以上两情况下,甲和乙容器中气体体积大小的比较,正确的是( )
| A. | ①甲>乙②甲>乙 | B. | ①甲>乙②甲<乙 | C. | ①甲<乙②甲>乙 | D. | ①甲>乙②甲=乙 |
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
(1)写出该反应的化学平衡常数表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,a小于(填“大于”、“小于”或“等于”)0.
(2)200℃时,向此密闭容器中充入0.20mol的N2和0.80mol的H2,反应初始6s内达到了平衡状态,N2的平均反应速率v(N2)=0.03mol•L-1•s-1.则6s时NH3的物质的量为0.18mol,c(N2)=0.22mol•L-1;此时N2的转化率为45%,如果这时向该密闭容器中再充入1mol氩气,N2的转化率不变(填“增大”“不变”“减小”).
(3)400℃时,2NH3(g)?N2(g)+3H2(g)的化学平衡常数为2,测得氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,该反应的v正(N2)大于(填“大于”、“小于”或“等于”)v逆(N2).
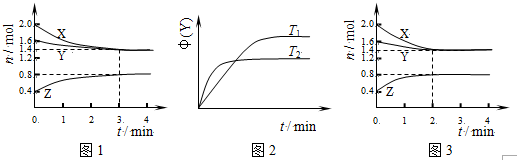
| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 反应进行的前3min内,用X表示的反应速率v(X)=0.2mol•(L•min)-1 | |
| C. | 保持其他条件不变,升高温度,反应的化学平衡常数K减小 | |
| D. | 其它条件不变,使用催化剂,则反应进程可能如图3所示 |