题目内容
4.在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),其平衡常数K和温度t的关系如下:| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(2)该反应的正反应为放热反应(“吸热”或“放热”);原因是升高温度平衡常数减小,平衡逆向移动
(3)能判断该反应是否已经达到化学平衡状态的是:D
A.混合气体总的物质的量不变 B.容器中压强不变
C.混合体系中平均摩尔质量不变 D.混合气体中CO浓度不变
(4)在850℃时,可逆反应:CO2(g)+H2(g)?CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O( mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
①前2min,CO2的平均反应速率;
②3min-4min达到平衡时CO的平衡浓度c3(c3精确到小数点后面三位数).
分析 (1)化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;
(2)升高温度,平衡向吸热方向移动,根据温度与化学平衡常数关系确定反应热;
(3)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
(4)①v(CO2 )=$\frac{△c}{△t}$;
②850℃时该反应化学平衡常数为1.0,根据化学平衡常数计算平衡时CO浓度.
解答 解:(1)该反应化学平衡常数K=$\frac{c(CO).c({H}_{2}O)}{c(C{O}_{2}).c({H}_{2})}$,故答案为:K=$\frac{c(CO).c({H}_{2}O)}{c(C{O}_{2}).c({H}_{2})}$;
(2)根据表中数据知,升高温度化学平衡常数减小,说明平衡逆向移动,则正反应是放热反应,
故答案为:放热;升高温度平衡常数减小平衡逆向移动;
(3)A.无论反应是否达到平衡状态,混合气体总的物质的量始终不变,不能据此判断平衡状态,故错误;
B.无论反应是否达到平衡状态,混合气体总物质的量不变,容器内压强始终不变,所以不能据此判断平衡状态,故错误;
C.无论反应是否达到平衡状态,混合气体总物质的量不变,则平均摩尔质量始终不变,不能据此判断平衡状态,故错误;
D.混合气体中CO浓度不变时,正逆反应速率相等,反应达到平衡状态,故正确;
故选D;
(4)①v(CO2 )=$\frac{△c}{△t}$=$\frac{0.2000.138}{2}$mol/(L.min)=0.031mol/(L.min),
答:二氧化碳的平均反应速率为0.031mol/(L.min);
②CO2(g)+H2(g)?CO(g)+H2O(g),
开始(mol/L)0.200 0.300 0 0
反应(mol/L) c3 c3 c3 c3
平衡(mol/L)(0.200-c3)(0.300-c3) c3 c3
该温度下化学平衡常数K为1.0,则$\frac{({c}_{3})^{2}}{(0.200-{c}_{3}).(0.300-{c}_{3})}$=1.0,
c3=0.120,
答:平衡时CO浓度为0.120mol/L.
点评 本题考查化学平衡常数计算、化学平衡状态判断、外界条件对化学平衡影响等知识点,侧重考查学生分析判断及计算能力,注意:化学平衡常数等于平衡时生成物浓度幂之积与反应物浓度幂之积的比,不是任意条件下的生成物浓度幂之积与反应物浓度幂之积的比,题目难度不大.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案已知达平衡后,降低温度,A的体积百分含量将减小.
(1)根据图1数据,写出反应的化学方程式A+2B?2C;
(2)此反应平衡常数的表达式为K=$\frac{{c}^{2}(C)}{c(A).{c}^{2}(B)}$.
(3)该反应的反应速率v和时间t的关系如图2所示:
①根据图2判断,在t3时刻改变的外界条件是升高温度.
②A的转化率最大的一段时间是t2~t3.
③各阶段的平衡常数如表所示:
| t2~t3 | t4~t5 | t5~t6 |
| K1 | K2 | K3 |
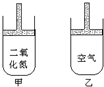 常温常压下在可移动活塞的甲、乙容器(如图)里分别充有等体积的二氧化氮(已建立了平衡:2NO2?N2O4;△H<0.)和空气,现分别进行下列两个实验:
常温常压下在可移动活塞的甲、乙容器(如图)里分别充有等体积的二氧化氮(已建立了平衡:2NO2?N2O4;△H<0.)和空气,现分别进行下列两个实验:①将两容器置于沸水中加热;②在活塞上都加2千克的砝码.
在以上两情况下,甲和乙容器中气体体积大小的比较,正确的是( )
| A. | ①甲>乙②甲>乙 | B. | ①甲>乙②甲<乙 | C. | ①甲<乙②甲>乙 | D. | ①甲>乙②甲=乙 |
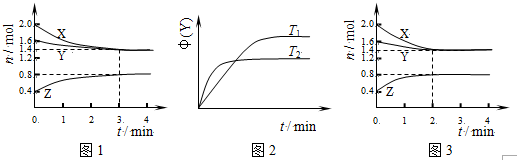
| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 反应进行的前3min内,用X表示的反应速率v(X)=0.2mol•(L•min)-1 | |
| C. | 保持其他条件不变,升高温度,反应的化学平衡常数K减小 | |
| D. | 其它条件不变,使用催化剂,则反应进程可能如图3所示 |
| A. | 溶液 | B. | 悬浊液 | C. | 乳浊液 | D. | 胶体 |
| A. | VA=0.15 mol•L-1•min-1 | B. | VC=0.6 mol•L-1•min-1 | ||
| C. | VB=0.6 mol•L-1•min-1 | D. | VD=0.1 mol•L-1•min-1 |
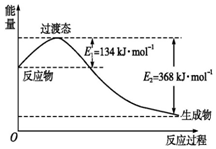 写出下列反应的热化学方程式
写出下列反应的热化学方程式