题目内容
10.在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量.(1)写出该反应的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ•mol-1.
(2)已知H2O(l)═H2O(g);△H=+44kJ•mol-1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是408.8kJ.
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是产物为氮气和水,无污染.
(4)已知N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ•mol-1,N2H4(g)+O2(g)═N2(g)+2H2O (g);△H=-534kJ•mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7kJ•mol-1.
(5)已知:N2 (g)+2O2 (g)═2NO2 (g)△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O (g)△H=-543kJ/mol
$\frac{1}{2}$H2 (g)+$\frac{1}{2}$F2 (g)═HF (g)△H=-269kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O (g)△H=-242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式:N2H4(g)+2F2(g)=N2(g)+4HF(g)△H=-1135kJ•mol-1.
(6)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-a kJ•mol-1
途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ•mol-1
2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=-c kJ•mol-1
2H2(g)+O2 (g)═2H2O(l)△H=-d kJ•mol-1 (abcd均为正值)
请回答下列问题:
判断等量的丙烷通过两种途径放出的热量,途径I放出的热量等于(填“大于”、“等于”或“小于”)途径II放出的热量.由于C3H8(g)═C3H6(g)+H2(g) 的反应中,反应物具有的总能量小于(填“大于”、“等于”或“小于”)生成物具有的总能量.b 与a、c、d的数学关系式是b=$\frac{c}{2}$+$\frac{d}{2}$-a.
分析 (1)根据题给条件厉害书写热化学方程式的原则写出;
(2)依据(2)中写出的热化学方程式和H2O(1)=H2O(g)△H=+44kJ/mol,利用盖斯定律写出热化学方程式计算;
(3)依据反应产物的性质分析无污染物产生分析;
(4)①N2(g)+2O2(g)═2NO2(g),△H=+67.7KJ•mol-1;
②N2H4(g)+O2(g)═N2(g)+2H2O (g),△H=-534KJ•mol-1
将方程式2×②-①得2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)根据盖斯定律计算焓变,并书写热化学方程式;
(5))①N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ•mol-1
②$\frac{1}{2}$H2(g)+$\frac{1}{2}$F2(g)=HF(g)△H=-269kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242kJ•mol-1
依据盖斯定律①-③×2+②×4得到:N2H4(g)+2F2(g)=N2(g)+4HF (g),利用盖斯定律计算得到焓变,并书写热化学方程式;
(6)根据盖斯定律来判断两种途径放热之间的关系;该反应属于吸热反应,反应物具有的总能量小于生成物的总能量;需要吸收能量,所以反应条件为加热;途径I:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-a kJ•mol-1
途径II:②C3H8(g)═C3H6(g)+H2(g)△H=+b kJ•mol-1
③2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=-c kJ•mol-1
④2H2(g)+O2 (g)═2H2O(l)△H=-d kJ•mol-1 反应①=反应②+反应③×$\frac{1}{2}$+反应④×$\frac{1}{2}$,根据盖斯定律来判断各步反应之间的关系.
解答 解:(1)已知0.4mol液态肼和足量H2O2(l)反应生成氮气和水蒸气时放出256.64kJ的热量,依据热化学方程式的书写原则,结合定量关系写出,1mol肼和过氧化氢反应生成氮气和水蒸气放出的热量=$\frac{256.64kJ×1mol}{0.4mol}$=641.6KJ,所以热化学方程式为:N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=-641.625kJ/mol,
故答案为:N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=-641.625kJ/mol;
(2)16g液态肼物质的量=$\frac{16g}{32g/mol}$=0.5mol,
由①N2H4(1)+2H2O2(1)=N2(g)+4H2O(g);△H=-641.6kJ/mol;
②H2O(1)=H2O(g)△H=+44kJ/mol,
结合盖斯定律的内容和要求,可以把②×4方向倒转得到③4H2O(g)=4H2O(l)△H=-44×4kJ/mol=-176kJ/mol,
①+③得到N2H4(1)+2H2O2(1)=N2(g)+4H2O(l);△H=-817.6kJ/mol,
所以0.5mol液态肼与足量双氧水反应生成氮气和液态水时,放出的热量=$\frac{0.5mol×817.6kJ}{1mol}$=408.8kJ,
故答案为:408.8;
(3)反应应用于火箭推进器,除释放出大量热量和快速生成大量气体产生巨大推力外,反应的生成物是氮气和水,很突出的优点是对环境无污染;
故答案为:产物为氮气和水,无污染;
(4)①N2(g)+2O2(g)═2NO2(g),△H=+67.7KJ•mol-1;
②N2H4(g)+O2(g)═N2(g)+2H2O (g),△H=-534KJ•mol-1
将方程式2×②-①得2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=2(-534KJ•mol-1)-(+67.7KJ•mol-1)=-1135.7kJ•mol-1,
故答案为:2N2H4(g)+2 NO2 (g)═3N2(g)+4 H2O(g)△H=-1135.7kJ•mol-1;
(5)①N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ•mol-1
②$\frac{1}{2}$H2(g)+$\frac{1}{2}$F2(g)=HF(g)△H=-269kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242kJ•mol-1
依据盖斯定律①-③×2+②×4得到:N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1135kJ•mol-1;
故答案为:N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1135kJ•mol-1;
(6)根据盖斯定律,煤作为燃料不管是一步完成还是分两步完成,反应物和产物的焓值是一定的,所以两途径的焓变值一样,放出的热量一样;由于C3H8(g)═C3H6(g)+H2(g) 的反应中△H>0,该反应是吸热反应,反应物具有的总能量小于生成物的总能量;
途径I:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-a kJ•mol-1
途径II:②C3H8(g)═C3H6(g)+H2(g)△H=+b kJ•mol-1
③2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=-c kJ•mol-1
④2H2(g)+O2 (g)═2H2O(l)△H=-d kJ•mol-1 反应①=反应②+反应③×$\frac{1}{2}$+反应④×$\frac{1}{2}$,所以-a=b+$\frac{1}{2}$(-c-d),所以b=-a+$\frac{1}{2}$(c+d)=b=$\frac{c}{2}$+$\frac{d}{2}$-a.
故答案为:等于;小于;b=$\frac{c}{2}$+$\frac{d}{2}$-a.
点评 本题考查学生盖斯定律的应用以及反应吸放热与反应物、生成物能量之间的关系,可以根据所学知识进行回答,难度不大.

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案| A. | 碳酸钙溶于盐酸:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 钠投入水中:Na+H2O═Na++2OH-+H2↑ | |
| C. | 铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氢氧化钡溶液滴入稀硫酸中:Ba2++SO42-═BaSO4↓ |
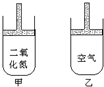 常温常压下在可移动活塞的甲、乙容器(如图)里分别充有等体积的二氧化氮(已建立了平衡:2NO2?N2O4;△H<0.)和空气,现分别进行下列两个实验:
常温常压下在可移动活塞的甲、乙容器(如图)里分别充有等体积的二氧化氮(已建立了平衡:2NO2?N2O4;△H<0.)和空气,现分别进行下列两个实验:①将两容器置于沸水中加热;②在活塞上都加2千克的砝码.
在以上两情况下,甲和乙容器中气体体积大小的比较,正确的是( )
| A. | ①甲>乙②甲>乙 | B. | ①甲>乙②甲<乙 | C. | ①甲<乙②甲>乙 | D. | ①甲>乙②甲=乙 |
| A. | 反应条件是加热的反应都是吸热反应 | |
| B. | 化学反应除了生成新的物质外,通常放出大量热 | |
| C. | 物质燃烧一定是放热反应 | |
| D. | 放热的化学反应不需要加热就能发生 |