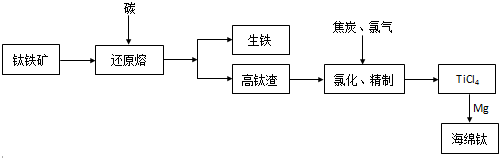
题目内容
16.下列物质提纯的方法中,正确的是( )| A. | 氯化铵溶液中含有少量的氯化铁,加入氢氧化钠溶液,过滤 | |
| B. | 用NaOH溶液除去CO中的少量CO2 | |
| C. | 将H2和O2混合气体通过炽热的CuO以除去氧气中的氢气 | |
| D. | H2S气体中含有水蒸气,将混合气体通过含有浓硫酸的洗气瓶 |
分析 A.加入氢氧化钠生成氯化钠,引入新杂质;
B.CO2可与NaOH反应,能被NaOH吸收;
C.混合气体加热时易爆炸;
D.浓硫酸与硫化氢发生氧化还原反应.
解答 解:A.加入氢氧化钠除去氯化铁的同时,也与铵根离子反应,且引入钠离子很难除去,故A错误;
B.CO2可与NaOH反应,能被NaOH吸收除去,故B正确;
C.H2和O2混合气体通过灼热CuO,反应后O2中会带入H2O(g),而且混合气体加热时易爆炸,故C错误;
D.浓硫酸具有氧化性,除水的同时把硫化氢也氧化了,故D错误.
故选B.
点评 本题考查物质的分离、提纯,为高频考点,侧重于学生的分析、实验能力的考查,注意把握实验的严密性和操作的可行性,难度不大.

练习册系列答案
相关题目
6.KMnO4+HCl-KCl+MnCl2+H2O+Cl2,方程式配平后,HCl前的化学计量数为( )
| A. | 8 | B. | 12 | C. | 16 | D. | 20 |
7.下列有关说法正确的是( )
| A. | 铜的金属活动性比铁弱,可以用铜罐代替铁罐盛装和运输浓硝酸 | |
| B. | 明矾净水与铁粉作食品的脱氧剂都利用了物质的还原性 | |
| C. | 钢瓶可以运输液氯 | |
| D. | 用氧化铝制成的耐高温坩埚可以用于熔融氢氧化钠 |
11.下列有关物质的结构的说法正确的是( )
| A. | 3.4g氨气中含有0.6NA个N-H键 | |
| B. | 78g Na2O2晶体中所含阴阳离子个数均为4NA | |
| C. | 只含有共价键的物质一定是共价化合物 | |
| D. | PCl3和H2O分子中所有原子的最外层都达到8电子稳定结构 |
1.甲乙两同学对保存已久的Na2SO3试剂进行试验探究.
取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解.
(1)测上述溶液的PH值,其PH值>7,原因是(用离子方程式表示)SO32-+H2O HSO3-+OH-
HSO3-+OH-
(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是溶液中的NO3-和H+在一起有强氧化性,会把亚硫酸钡氧化成硫酸钡
(3)假设试剂由Na2SO3和Na2SO4组成,设计试验方案,进行成分检验,他们决定继续探究,请在答题卡上写出实验步骤、预期现象和结论.
限选试剂及仪器:稀盐酸、稀硝酸、氯化钡溶液,品红溶液,酸性高锰酸溶液,NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
(4)经实验检验后,确实已变质,现准确测定其中Na2SO3的含量.实验如下:
①配制250ml 约0.2mol•L-1 Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入250mL容量瓶,洗涤,定容,摇匀.
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将 0.05mol•L-1酸性高锰酸钾装入50ml酸式(填酸式或碱式)滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4VmL.
③计算Na2SO3的质量分数=$\frac{2.5V×126}{2000w}$×100%(只列出计算式,不要求算出结果)
取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解.
(1)测上述溶液的PH值,其PH值>7,原因是(用离子方程式表示)SO32-+H2O
 HSO3-+OH-
HSO3-+OH-(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是溶液中的NO3-和H+在一起有强氧化性,会把亚硫酸钡氧化成硫酸钡
(3)假设试剂由Na2SO3和Na2SO4组成,设计试验方案,进行成分检验,他们决定继续探究,请在答题卡上写出实验步骤、预期现象和结论.
限选试剂及仪器:稀盐酸、稀硝酸、氯化钡溶液,品红溶液,酸性高锰酸溶液,NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置. | |
| 步骤2:取适量步骤1所得溶液于试管中,加入少量的酸性高锰酸钾溶液. | 若溶液褪色,说明其有Na2SO3 若溶液不褪色,说明其中没有Na2SO3 |
| 步骤3:再取适量步骤1所得溶液于另一试管中,先加入足量的稀盐酸,再滴加氯化钡溶液. | 如果有白色沉淀生成,则说明其中有Na2SO4,已经变质. 如果没有白色沉淀生成,则说明其中没有Na2SO4 |
①配制250ml 约0.2mol•L-1 Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入250mL容量瓶,洗涤,定容,摇匀.
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将 0.05mol•L-1酸性高锰酸钾装入50ml酸式(填酸式或碱式)滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4VmL.
③计算Na2SO3的质量分数=$\frac{2.5V×126}{2000w}$×100%(只列出计算式,不要求算出结果)
8.下列叙述正确的是( )
| A. | 1mol H2O的质量为18g/mol | |
| B. | 2g H2含有的氢原子数为6.02×1023 | |
| C. | 标准状况下,1mol SO3的体积为22.4L | |
| D. | 1L 1mol•L-1 NaOH溶液中含1mol Na+ |
3.有关下列微粒的化学用语正确的是( )
| A. | CS2的电子式为: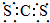 | |
| B. | Ca2+的离子结构示意图为: | |
| C. | HClO的结构式为:H-Cl-O | |
| D. | 质子数为35,中子数为46的核素的核素符号为:${\;}_{35}^{81}$Br |
4.塑料抗氧化剂C可通过下列反应合成:

下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | 物质A中所含碳原子可能在同一个平面内 | |
| B. | 物质A生成物质B是加成反应,物质B生成物质C是酯化反应 | |
| C. | 物质B具有酚羟基,但不能与浓溴水产生白色沉淀 | |
| D. | 1mol抗氧化剂C能与NaOH溶液反应,最多消耗3 molNaOH |