题目内容
4.钛及其合金具有密度小、强度高、耐酸、碱腐蚀等优良性能,被广泛用于航天、航空、航海、石油、化工、医药等部门.由钒钛磁铁矿经“选矿”得到的钛铁矿提取金属钛(海绵钛)的主要工艺过程如下: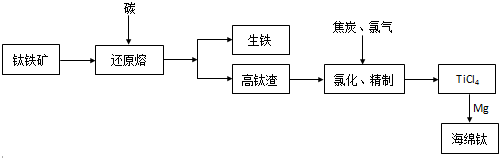
(1)钛铁矿的主要成分为FeTiO3.控制电炉熔炼温度(<1500K),用等物质的量的碳还原出铁,而钛以二氧化钛的形式进入炉渣浮于熔融铁之上,使钛与铁分离,钛被富集.写出相关反应:FeTiO3+C$\frac{\underline{\;<1500K\;}}{\;}$Fe+TiO2+CO.
(2)已知氯化反应过程中会产生一种无色可燃性气体,请写出在1073-1273K下氯化反应的化学方程式:2C+2Cl2+TiO2=$\frac{\underline{\;1073-1273K\;}}{\;}$2CO+TiCl4.
(3)氯化得到的TiCl4中含有的VOCl3必须用高效精馏的方法除去.实际生产中常在409K下用Cu还原VOCl3,反应物的物质的量之比为1:1,生成氯化亚铜和难溶于TiCl4的还原物,写出此反应方程式:Cu+VOCl3$\frac{\underline{\;409K\;}}{\;}$CuCl+VOCl2.
(4)TiCl4的还原通常在800°C的条件下进行,反应过程中通入氩气的目的是防止Mg在高温下与空气中O2、CO2等反应,试写出从还原产物中分离出海绵钛的步骤①加入过量的稀盐酸②过滤③洗涤、干燥固体.
(5)电解法冶炼钛的一种生产工艺是将TiO2与粉末与黏结剂混合后,压制成电解阴极板,用石墨作阳极,熔融氧化钙作电解质,电解过程中阳极生成O2和CO2气体,破碎洗涤阴极板即得到电解钛.试写出阴极反应方程式TiO2+4e-=Ti+2O2-.
分析 钛铁矿在高温条件下被碳还原,得到生铁和高钛渣(TiO2),高钛渣与碳、氯气高温条件下生成TiCl4,TiCl4用镁还原可知海绵钛,
(1)FeTiO3高温下与等物质的量的碳还原出铁同时生成二氧化钛根据元素守恒和电子得失守恒书写化学方程式;
(2)氯化反应是碳、氯气与二氧化钛的反应,根据元素守恒可知,过程中会产生一种无色可燃性气体应为CO,据此书写化学方程式;
(3)在409K下用Cu还原VOCl3,反应物的物质的量之比为1:1,生成氯化亚铜和难溶于TiCl4的还原物应为VOCl2,据此书写反应方程式;
(4)用Mg还原TiCl4制金属钛取过程中必须在1070K的温度下进行,而在此温度下镁、钛都会与氧气反应;金属钛中混有少量杂质镁,由题给信息知钛的化学活性很小,仅能与氧气等几种物质起反应,而与稀盐酸或稀硫酸等不反应,据此答题;
(5)电解时,阴极发生还原反应生成Ti,电极方程式为TiO2+4e-=Ti+2O2-,阳极发生氧化反应,电极方程式为2O2-+4e-=O2,阳极生成O2,由于阳极材料为石墨,则氧气和石墨反应可生成CO2等,据此答题.
解答 解:钛铁矿在高温条件下被碳还原,得到生铁和高钛渣(TiO2),高钛渣与碳、氯气高温条件下生成TiCl4,TiCl4用镁还原可知海绵钛,
(1)FeTiO3高温下与等物质的量的碳还原出铁同时生成二氧化钛,反应的化学方程式为FeTiO3+C$\frac{\underline{\;<1500K\;}}{\;}$Fe+TiO2+CO,
故答案为:FeTiO3+C$\frac{\underline{\;<1500K\;}}{\;}$Fe+TiO2+CO;
(2)氯化反应是碳、氯气与二氧化钛的反应,根据元素守恒可知,过程中会产生一种无色可燃性气体应为CO,反应的化学方程式为2C+2Cl2+TiO2=$\frac{\underline{\;1073-1273K\;}}{\;}$2CO+TiCl4,
故答案为:2C+2Cl2+TiO2=$\frac{\underline{\;1073-1273K\;}}{\;}$2CO+TiCl4;
(3)在409K下用Cu还原VOCl3,反应物的物质的量之比为1:1,生成氯化亚铜和难溶于TiCl4的还原物应为VOCl2,反应的化学方程式为Cu+VOCl3$\frac{\underline{\;409K\;}}{\;}$CuCl+VOCl2,
故答案为:Cu+VOCl3$\frac{\underline{\;409K\;}}{\;}$CuCl+VOCl2;
(4)用Mg还原TiCl4制金属钛取过程中必须在1070K的温度下进行,而在此温度下镁、钛都会与氧气反应,所以反应过程中通入氩气的目的是防止Mg在高温下与空气中O2、CO2等反应,金属钛中混有少量杂质镁,由题给信息知钛的化学活性很小,仅能与氧气等几种物质起反应,而与稀盐酸或稀硫酸等不反应,所以实验操作为①加入过量的稀盐酸②过滤③洗涤、干燥固体,
故答案为:防止Mg在高温下与空气中O2、CO2等反应;①加入过量的稀盐酸②过滤③洗涤、干燥固体;
(5)电解时,阴极发生还原反应生成Ti,电极方程式为TiO2+4e-=Ti+2O2-,阳极发生氧化反应,电极方程式为2O2-+4e-=O2,阳极生成O2,由于阳极材料为石墨,则氧气和石墨反应可生成CO2等,
故答案为:TiO2+4e-=Ti+2O2-.
点评 本题考查物质的制备实验方案的设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握实验的基本原理和物质的性质.

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案 实验室用乙醇和必要的无机试剂制取1,2一二溴乙烷的装置如图,1,2一二溴乙烷的部分性质如下表:
实验室用乙醇和必要的无机试剂制取1,2一二溴乙烷的装置如图,1,2一二溴乙烷的部分性质如下表:| 常温下颜色状态 | 密度 | 熔点 | 沸点 | 溶解性 |
| 无色液体 | 2.18g/cm3 | 9.79℃ | 131.4℃ | 不溶于水、一溶于醇、醚、丙酮 |
(1)装置A的烧瓶中装入乙醇和浓硫酸的混合液后还需加入碎瓷片(或沸石).
(2)实验进行时若装置D中的导气管发生堵塞,此时装置B中可观察到的现象为B中的水面下降,玻璃管中的水面上升甚至会溢出.
(3)装置C的试剂瓶中盛有10%的NaOH溶液,其作用是洗去乙烯中混有的少量SO2、CO2.
(4)装置D的试管中装有液溴,实验开始后观察到的主要现象是液体颜色变浅.
(5)开始反应时向装置D的烧杯中加入冰水,这是为了降温,防止液溴挥发.
(6)装置E的作用是尾气处理,吸收多余的Br2,防止污染环境.
(7)某学生使用46g乙醇在浓硫酸存在下与足量的液溴充分反应,最终得到1,2一二溴乙烷178.6g,则生成1,2一二溴乙烷的产率为95%.
 结构的有机物的同分异构体共有(不考虑立体异构)( )
结构的有机物的同分异构体共有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | ②>①>④>③ | B. | ①=②=③=④ | C. | ②=③>①=④ | D. | ②<①<③<④ |
已知:①S2C12不稳定,进一步氯化可得SCl2;②S2Cl2、SCl2都能与水反应,2S2Cl2+2H2O═3S↓+SO2↑+4HCl,3SCl2+4H2O═2S↓+H2SO4+6HCl;③几种物质的熔沸点如表:
| 物质 | S | SCl2 | S2Cl2 |
| 熔点/℃ | 445 | 59 | 137 |
| 沸点/℃ | 113 | -122 | -77 |

(1)B装置中仪器a的名称蒸馏烧瓶.
(2)装置的连接顺序是(每个装置只能使用一次)ACEBD.
(3)装置D的作用是防止空气中的水蒸气进入装置B,吸收多余的氯气.
(4)实验中先点燃A装置酒精灯制取Cl2,当当E中充满黄绿色的气体时,说明排净空气,再点燃E处酒精灯.
(5)由实验粗产品获得纯净的S2Cl2,需要进行的操作是蒸馏,该操作的温度范围是59℃~137℃.
(6)请设计实验证明所得产品中是否含有杂质SCl2取少量产品加入试管中,再加入适量蒸馏水,振荡、静置.取少量上层清夜,滴加氯化钡溶液,若有白色沉淀生成,证明有S2Cl2,否则无S2Cl2.
①2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2TiCl4+2FeCl3+6CO
②在氩气环境中,2Mg+TiCl4$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2
下列判断不正确的是( )
| A. | 反应②属于置换反应 | |
| B. | 反应②中氯化物的总质量保持不变 | |
| C. | 反应①、②中钛元素的化合价都改变 | |
| D. | 反应②中,氩气只作为保护气并不参加反应 |
| A. | 氯化铵溶液中含有少量的氯化铁,加入氢氧化钠溶液,过滤 | |
| B. | 用NaOH溶液除去CO中的少量CO2 | |
| C. | 将H2和O2混合气体通过炽热的CuO以除去氧气中的氢气 | |
| D. | H2S气体中含有水蒸气,将混合气体通过含有浓硫酸的洗气瓶 |
 已知NaCl的摩尔质量为Mg.mol-1,NaCl晶体的密度为ρg.cm-3,图大正方体为NaCl晶体的最小重复单元(晶胞),其中顶点离子为8个晶胞所共有,晶胞中Na+与最邻近的Cl-的核间距离为a cm,则阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为Mg.mol-1,NaCl晶体的密度为ρg.cm-3,图大正方体为NaCl晶体的最小重复单元(晶胞),其中顶点离子为8个晶胞所共有,晶胞中Na+与最邻近的Cl-的核间距离为a cm,则阿伏加德罗常数的值可表示为( )| A. | 2Ma3ρ | B. | $\frac{M}{{a}^{3}ρ}$ | C. | $\frac{2M}{{a}^{3}ρ}$ | D. | $\frac{M}{2{a}^{3}ρ}$ |

 .
. $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.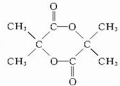 .
.