题目内容
6.KMnO4+HCl-KCl+MnCl2+H2O+Cl2,方程式配平后,HCl前的化学计量数为( )| A. | 8 | B. | 12 | C. | 16 | D. | 20 |
分析 反应中高锰酸钾中的锰元素化合价从+7价降为氯化锰中+2价,氯化氢中-1价的氯,部分升高到氯气中0价,依据氧化还原反应中得失电子守恒规律结合原子个数守恒规律配平化学方程式即可.
解答 解:反应中高锰酸钾中的锰元素化合价从+7价降为氯化锰中+2价,氯化氢中-1价的氯,部分升高到氯气中0价,1mol高锰酸钾参加反应得到5mol电子,生成1mol氯气,有2mol氯离子失去2mol电子,要使氧化还原中得失电子守恒,则最小公倍数为10,高锰酸钾系数为2,氯气系数为5,依据锰、钾原子个数守恒,氯化钾系数为2,氯化锰系数为2,依据氯原子个数守恒,氯化氢系数为16,依据氢原子个数守恒,水分子系数为8,配平的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,
故选C.
点评 本题考查了氧化还原反应方程式的书写方法,题目难度不大,明确氧化还原反应方程式中氧化剂、还原剂得失电子守恒、原子个数守恒是解题关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
16.下列说法中正确的是( )
| A. | 苯酚俗称石炭酸,酸性比碳酸强 | |
| B. | 皮肤上若沾有少量苯酚,正确的处理方法是用70℃热水洗 | |
| C. | 实验室做钠与乙醇的实验时,余下的钠屑投入到废液缸中 | |
| D. | 乙醇熔沸点比含相同碳原子的烷烃熔沸点高的主要原因是乙醇分子之间易形成氢键 |
17.${\;}_{6}^{13}$C和${\;}_{6}^{14}$C是碳元素的两种核素,它们具有不同的( )
| A. | 质子数 | B. | 中子数 | C. | 电子数 | D. | 核外电子排布 |
14.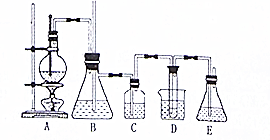 实验室用乙醇和必要的无机试剂制取1,2一二溴乙烷的装置如图,1,2一二溴乙烷的部分性质如下表:
实验室用乙醇和必要的无机试剂制取1,2一二溴乙烷的装置如图,1,2一二溴乙烷的部分性质如下表:
请回答下列问题:
(1)装置A的烧瓶中装入乙醇和浓硫酸的混合液后还需加入碎瓷片(或沸石).
(2)实验进行时若装置D中的导气管发生堵塞,此时装置B中可观察到的现象为B中的水面下降,玻璃管中的水面上升甚至会溢出.
(3)装置C的试剂瓶中盛有10%的NaOH溶液,其作用是洗去乙烯中混有的少量SO2、CO2.
(4)装置D的试管中装有液溴,实验开始后观察到的主要现象是液体颜色变浅.
(5)开始反应时向装置D的烧杯中加入冰水,这是为了降温,防止液溴挥发.
(6)装置E的作用是尾气处理,吸收多余的Br2,防止污染环境.
(7)某学生使用46g乙醇在浓硫酸存在下与足量的液溴充分反应,最终得到1,2一二溴乙烷178.6g,则生成1,2一二溴乙烷的产率为95%.
 实验室用乙醇和必要的无机试剂制取1,2一二溴乙烷的装置如图,1,2一二溴乙烷的部分性质如下表:
实验室用乙醇和必要的无机试剂制取1,2一二溴乙烷的装置如图,1,2一二溴乙烷的部分性质如下表:| 常温下颜色状态 | 密度 | 熔点 | 沸点 | 溶解性 |
| 无色液体 | 2.18g/cm3 | 9.79℃ | 131.4℃ | 不溶于水、一溶于醇、醚、丙酮 |
(1)装置A的烧瓶中装入乙醇和浓硫酸的混合液后还需加入碎瓷片(或沸石).
(2)实验进行时若装置D中的导气管发生堵塞,此时装置B中可观察到的现象为B中的水面下降,玻璃管中的水面上升甚至会溢出.
(3)装置C的试剂瓶中盛有10%的NaOH溶液,其作用是洗去乙烯中混有的少量SO2、CO2.
(4)装置D的试管中装有液溴,实验开始后观察到的主要现象是液体颜色变浅.
(5)开始反应时向装置D的烧杯中加入冰水,这是为了降温,防止液溴挥发.
(6)装置E的作用是尾气处理,吸收多余的Br2,防止污染环境.
(7)某学生使用46g乙醇在浓硫酸存在下与足量的液溴充分反应,最终得到1,2一二溴乙烷178.6g,则生成1,2一二溴乙烷的产率为95%.
1.下列是说法正确的是( )
| A. | 在水蒸气分子中因存在氢键,所以水的沸点很高 | |
| B. | 用电子式表示H2O的形成过程: | |
| C. | 碱金属的熔点、沸点随原子序数的递增而升高,卤素单质的熔点、沸点随原子序数的递增而降低 | |
| D. | 卤素单质的氧化性随原子序数的逐渐增大而增强,其卤化氢的沸点依次升高 |
18.下列操作不能用于检验NH3的是( )
| A. | 气体使酚酞试液变红 | B. | 气体能使湿润的红色石蕊试纸变蓝 | ||
| C. | 气体与蘸有浓H2SO4的玻璃棒靠近 | D. | 气体与蘸有浓盐酸的玻璃棒靠近 |
15.分子式为C3H4Cl2且含有 结构的有机物的同分异构体共有(不考虑立体异构)( )
结构的有机物的同分异构体共有(不考虑立体异构)( )
 结构的有机物的同分异构体共有(不考虑立体异构)( )
结构的有机物的同分异构体共有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
16.下列物质提纯的方法中,正确的是( )
| A. | 氯化铵溶液中含有少量的氯化铁,加入氢氧化钠溶液,过滤 | |
| B. | 用NaOH溶液除去CO中的少量CO2 | |
| C. | 将H2和O2混合气体通过炽热的CuO以除去氧气中的氢气 | |
| D. | H2S气体中含有水蒸气,将混合气体通过含有浓硫酸的洗气瓶 |
 有A、B、C、D四种短周期元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p 轨道中有3个未成对电子,其气态氢化物的水溶性在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4.请问答下列问题:
有A、B、C、D四种短周期元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p 轨道中有3个未成对电子,其气态氢化物的水溶性在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4.请问答下列问题: ,CB3分子的VSEPR模型为四面体形.
,CB3分子的VSEPR模型为四面体形.