题目内容
1.甲乙两同学对保存已久的Na2SO3试剂进行试验探究.取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解.
(1)测上述溶液的PH值,其PH值>7,原因是(用离子方程式表示)SO32-+H2O
 HSO3-+OH-
HSO3-+OH-(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是溶液中的NO3-和H+在一起有强氧化性,会把亚硫酸钡氧化成硫酸钡
(3)假设试剂由Na2SO3和Na2SO4组成,设计试验方案,进行成分检验,他们决定继续探究,请在答题卡上写出实验步骤、预期现象和结论.
限选试剂及仪器:稀盐酸、稀硝酸、氯化钡溶液,品红溶液,酸性高锰酸溶液,NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置. | |
| 步骤2:取适量步骤1所得溶液于试管中,加入少量的酸性高锰酸钾溶液. | 若溶液褪色,说明其有Na2SO3 若溶液不褪色,说明其中没有Na2SO3 |
| 步骤3:再取适量步骤1所得溶液于另一试管中,先加入足量的稀盐酸,再滴加氯化钡溶液. | 如果有白色沉淀生成,则说明其中有Na2SO4,已经变质. 如果没有白色沉淀生成,则说明其中没有Na2SO4 |
①配制250ml 约0.2mol•L-1 Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入250mL容量瓶,洗涤,定容,摇匀.
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将 0.05mol•L-1酸性高锰酸钾装入50ml酸式(填酸式或碱式)滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4VmL.
③计算Na2SO3的质量分数=$\frac{2.5V×126}{2000w}$×100%(只列出计算式,不要求算出结果)
分析 (1)Na2SO3为强碱弱酸盐,SO32-水解呈碱性,其PH值>7;
(2)检验Na2SO3样品是否变质,实质是检验是否生成Na2SO4,即检验样品溶液中是否存在SO42-,但加入硝酸钡溶液,溶液中的NO3-和H+在一起有强氧化性,会把亚硫酸钡氧化成硫酸钡;
(3)假设试剂由Na2SO3和Na2SO4组成,进行成分检验实质是检验SO32-和SO42-,SO32-具有强还原性,可用酸性高锰酸钾溶液检验,SO42-检验方法为先加入足量的稀盐酸,再滴加氯化钡溶液看是否有白色沉淀生成;
(4)①配制250ml 约0.2mol•L-1 Na2SO3溶液,溶液应转入250mL容量瓶洗涤,定容,摇匀;
②酸性高锰酸钾溶液具有强氧化性会腐蚀橡胶,应装入酸式滴定管;
③根据氧化还原反应得失电子守恒,由消耗高锰酸钾的量计算样品中Na2SO3的质量,从而求出Na2SO3的质量分数.
解答 解:(1)Na2SO3溶液PH值>7,因为其为强碱弱酸盐,SO32-水解呈碱性,水解的离子方程式为SO32-+H2O HSO3-+OH-,
HSO3-+OH-,
故答案为:SO32-+H2O HSO3-+OH-;
HSO3-+OH-;
(2)检验Na2SO3样品是否变质,实质是检验是否生成Na2SO4,即检验样品溶液中是否存在SO42-的,但加入硝酸钡溶液,溶液中的NO3-和H+在一起有强氧化性,会把亚硫酸钡氧化成硫酸钡,无法确定样品是否变质生成Na2SO4,
故答案为:溶液中的NO3-和H+在一起有强氧化性,会把亚硫酸钡氧化成硫酸钡;
(3)假设试剂由Na2SO3和Na2SO4组成,进行成分检验实质是检验SO32-和SO42-,SO32-具有强还原性,根据提供的试剂,可用酸性高锰酸钾溶液检验,若酸性高锰酸溶液褪色,说明中有Na2SO3,若酸性高锰酸溶液不褪色,说明中没有Na2SO3,SO42-检验方法为先加入足量的稀盐酸,再滴加氯化钡溶液看是否有白色沉淀生成,如果有白色沉淀生成,则说明其中有Na2SO4,已经变质,如果没有白色沉淀生成,则说明没有Na2SO4;
故答案为:酸性高锰酸钾;Na2SO3;Na2SO3;氯化钡;Na2SO4;Na2SO4;
(4)①配制250ml 约0.2mol•L-1 Na2SO3溶液,准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入250mL容量瓶洗涤,定容,摇匀;
故答案为:250mL容量瓶;
②酸性高锰酸钾溶液具有强氧化性会腐蚀橡胶,应装入酸式滴定管,
故答案为:酸式;
③根据氧化还原反应得失电子守恒,设25.00ml Na2SO3溶液中Na2SO3物质的量为n,则有
5Na2SO3~2KMnO4
5 2
n 0.05V×10-3
则n=$\frac{5×0.05V}{2000}$mol,则w克试样中m(Na2SO3)=n×$\frac{250}{25}$×126=$\frac{2.5V×126}{2000}$g,
则Na2SO3的质量分数=$\frac{2.5V×126}{2000w}$×100%,
故答案为:$\frac{2.5V×126}{2000w}$×100%.
点评 本题考查了物质组成的实验探究,实验过程分析判断,实验设计的分析应用.物质性质和实验现象的理解应用时解题关键,题目难度较大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | ②>①>④>③ | B. | ①=②=③=④ | C. | ②=③>①=④ | D. | ②<①<③<④ |
①2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2TiCl4+2FeCl3+6CO
②在氩气环境中,2Mg+TiCl4$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2
下列判断不正确的是( )
| A. | 反应②属于置换反应 | |
| B. | 反应②中氯化物的总质量保持不变 | |
| C. | 反应①、②中钛元素的化合价都改变 | |
| D. | 反应②中,氩气只作为保护气并不参加反应 |
| A. | 氯化铵溶液中含有少量的氯化铁,加入氢氧化钠溶液,过滤 | |
| B. | 用NaOH溶液除去CO中的少量CO2 | |
| C. | 将H2和O2混合气体通过炽热的CuO以除去氧气中的氢气 | |
| D. | H2S气体中含有水蒸气,将混合气体通过含有浓硫酸的洗气瓶 |
| A. | K+、Na+、HCO3-、Cl- | B. | K+、AlO2-、Br-、Cl- | ||
| C. | Na+、Cl-、NO3-、I- | D. | Al3+、NH4+、Cl-、SO42- |
| A. | 原子半径:F<Mg<K | B. | 碱性:Al(OH)3<Mg(OH)2<KOH | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 稳定性:PH3>H2S>NH3 |
 有A、B、C、D四种短周期元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p 轨道中有3个未成对电子,其气态氢化物的水溶性在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4.请问答下列问题:
有A、B、C、D四种短周期元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p 轨道中有3个未成对电子,其气态氢化物的水溶性在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4.请问答下列问题: ,CB3分子的VSEPR模型为四面体形.
,CB3分子的VSEPR模型为四面体形.

 .
. $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.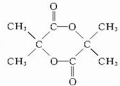 .
.