题目内容
7.下列实验操作正确的是( )| A. | 用量筒量取25.00mL蒸馏水 | B. | 用分液漏斗分离乙醇和水 | ||
| C. | 用烧杯溶解FeCl3试样 | D. | 用托盘天平称量NaCl固体5.80g |
分析 A.量筒的最小读数为0.1mL;
B.乙醇与水混溶,混合液不分层;
C.可以在烧杯中溶解氯化铁;
D.托盘天平的最小读数为0.1g.
解答 解:A.量筒只能读到0.1mL,无法用量筒量取25.00mL蒸馏水,故A错误;
B.乙醇与水不分层,无法用分液漏斗分离乙醇和水,故B错误;
C.可以用烧杯溶解FeCl3试样,故C正确;
D.托盘天平只能读到0.1g,无法用托盘天平称量NaCl固体5.80g,故D错误;
故选C.
点评 本题考查了化学实验方案的评价,题目难度不大,明确常见仪器的构造及使用方法为解答关键,试题侧重基础知识的考查,有利于提高学生的化学实验能力.

练习册系列答案
相关题目
15.某元素的原子核外有三个电子层,其最外层电子数是次外层电子数的一半,则该元素位于周期表中( )
| A. | 第四周期第ⅢA族 | B. | 第四周期第ⅦA族 | C. | 第三周期第ⅣA族 | D. | 第三周期第ⅣB族 |
15.已知H2(g)、CO(g)、CH3OH(l)的燃烧热△H分别是-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.下列有关叙述正确的是( )
| A. | 甲醇不完全燃烧生成CO和液态水的热化学方程式:CH3OH(l)+O2 (g)═CO(g)+2H2O(l)△H1=-1009.5kJ•mol-1 | |
| B. | CH3OH(l)+$\frac{1}{2}$O2 (g)═CO2(g)+2H2 (g)△H1=-440.7kJ•mol-1 | |
| C. | 2H2O(g)═2H2(g)+O2(g)△H1=+571.6 kJ•mol-1 | |
| D. | 已知:S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)=SO2(g)△H2;则△H1>△H2 |
2.若已知:
H2(g)+$\frac{1}{2}$O2(g)=H2O(g):△H=a kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(l):△H=b kJ/mol
2H2O(g)=2H2(g)+O2(g):△H=c kJ/mol
关于它们的下列表述正确的是( )
H2(g)+$\frac{1}{2}$O2(g)=H2O(g):△H=a kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(l):△H=b kJ/mol
2H2O(g)=2H2(g)+O2(g):△H=c kJ/mol
关于它们的下列表述正确的是( )
| A. | a+b+c=0 | B. | c=2a | C. | a>b | D. | c=a+b |
12.下列说法或表示法正确的是( )
| A. | 由“C(s,石墨)-→C(s,金刚石)△H=+119 kJ•mol-1”可知金刚石比石墨稳定 | |
| B. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 | |
| C. | 在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 | |
| D. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
17.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 常温常压下,16 g O3所含的氧原子数目为NA | |
| B. | 1 mol•L-1CaCl2溶液中含有的Cl-数目为2NA | |
| C. | 5.6 g Fe与足量盐酸反应失去的电子数目为0.3NA | |
| D. | 标准状况下,22.4 L苯含有的分子数目为NA |
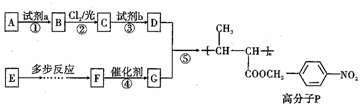
 ,试剂a是浓硫酸和浓硝酸.
,试剂a是浓硫酸和浓硝酸. +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$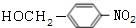 +NaCl.
+NaCl.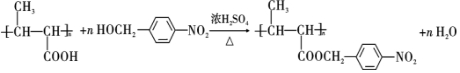 .
.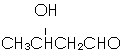 ,以E为起始原料.选用必要的无机试剂合成F,写出合成路线
,以E为起始原料.选用必要的无机试剂合成F,写出合成路线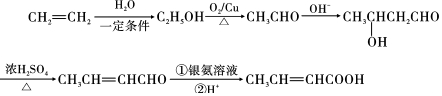 (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).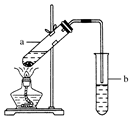 实验室常用如图所示装置制取少量乙酸乙酯.请回答下列问题:
实验室常用如图所示装置制取少量乙酸乙酯.请回答下列问题: