题目内容
2.若已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(g):△H=a kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(l):△H=b kJ/mol
2H2O(g)=2H2(g)+O2(g):△H=c kJ/mol
关于它们的下列表述正确的是( )
| A. | a+b+c=0 | B. | c=2a | C. | a>b | D. | c=a+b |
分析 ①H2(g)+$\frac{1}{2}$O2(g)=H2O(g):△H=a kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l):△H=b kJ/mol
③2H2O(g)=2H2(g)+O2(g):△H=c kJ/mol
A.根据盖斯定律,①+②可得:2H2(g)+O2(g)=H2O(g)+H2O(l),则①+②-③≠0;
B.①为放热反应,a为负值,③为吸热反应,c正值,则c>2a;
C.气态水具有能量较高,则反应①放出热量少,结合放热反应的焓变为负值分析;
D.①②为放热反应,则a、b为负值,③为吸热反应,则c为正值,故c>a+b.
解答 解:①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=a kJ/mol、②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=b kJ/mol、③2H2O(g)=2H2(g)+O2(g)△H=c kJ/mol,
A.根据盖斯定律,将热化学方程式①+②得:2H2(g)+O2(g)=H2O(g)+H2O(l),则①+②-③≠0,所以a+b+c≠0,故A错误;
B.H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=a kJ/mol为放热反应,则a<0,2H2O(g)=2H2(g)+O2(g)△H=c kJ/mol为吸热反应,则c为正值,所以c=-2a,故B错误;
C.水在气态具有能量较高,则反应H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=a kJ/mol放出热量比反应H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=b kJ/mol放出热量多,由于焓变为负值,则a>b,故C正确;
D.氢气燃烧为放热反应,放热反应的焓变为负值,则a、b小于0,水的分解为吸热反应,则c大于0,所以c>a+b,故D错误;
故选C.
点评 本题考查了反应热与焓变的综合应用,题目难度中等,明确放热反应、吸热反应与焓变的关系为解答关键,注意放热反应的焓变为负值,为易错点,试题有利于提高学生的灵活应用能力.

| 操作、现象 | 解释 | |
| A | 把生铁放置于潮湿的空气中,铁表面有一层红棕色的斑点 | 铁在潮湿的空气中易生成Fe(OH)3 |
| B | 向KI淀粉溶液中加入FeCl3溶液,溶液变蓝 | Fe3+能与淀粉发生显色反应 |
| C | 新制Fe(OH)2露置于空气中一段时间,白色物质变成了红褐色 | 说明Fe(OH)2易被O2氧化成Fe(OH)3 |
| D | 向稀硝酸中加入少量铁粉,有气泡产生 | 说明Fe置换出硝酸中的氢,生成了氢气 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| B. | 常温下,将稀CH3COONa溶液加水稀释后,溶液中n(H+)•n(OH-)不变 | |
| C. | 标准状况下,5.6L由CH4与C2H4组成的混合气体中含有的氢原子数目为6.02×1023 | |
| D. | 一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3KJ,则其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6KJ•mol-1 |
| A. | 用量筒量取25.00mL蒸馏水 | B. | 用分液漏斗分离乙醇和水 | ||
| C. | 用烧杯溶解FeCl3试样 | D. | 用托盘天平称量NaCl固体5.80g |
| A. | 增大压强可加快该反应速率 | |
| B. | 升高温度能加快该反应速率 | |
| C. | 增大H2的浓度能加快该反应速率 | |
| D. | 密闭容器中,通入略过量的CO2可以实现H2的100%转化 |
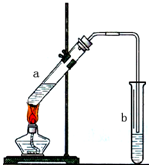 用如图示装置制取少量乙酸乙酯.已知乙酸乙酯的沸点低于乙醇.请填空:
用如图示装置制取少量乙酸乙酯.已知乙酸乙酯的沸点低于乙醇.请填空: