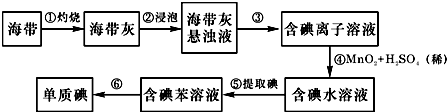
题目内容
15.下列物质的熔、沸点高低顺序,正确的是( )| A. | 金刚石>NaCl>O2 | B. | F2>Cl2>Br2 | C. | S>NaBr>金刚石 | D. | SiH4<CH4<干冰 |
分析 比较依据是:原子晶体>离子晶体>分子晶体.对于离子晶体来说,离子键越强,物质的熔、沸点越高;其中组成相似的离子化合物,其离子键的强弱主要决定于离子的电荷数跟离子半径之比,离子半径越小,电荷数越大,形成的离子键越强,熔、沸点就越高.对于分子晶体来说,分子间作用力越大,物质的熔、沸点就越高,其中组成和结构相似的分子晶体,分子间作用力一般随着式量的增大而增强,熔、沸点则逐渐升高.
解答 解:A、三种晶体中金刚石为原子晶体,氯化钠为离子晶体,氧气为分子晶体,原子晶体>离子晶体>分子晶体,故A正确;
B、三种晶体都为分子晶体,分子间作用力越大,物质的熔、沸点就越高,正确顺序应为:F2<Cl2<Br2,故B错误;
C、三种晶体中,S为分子晶体,溴化钠为离子晶体,金刚石为原子晶体,原子晶体>离子晶体>分子晶体,正确顺序为:S<NaBr<金刚石,故C错误.
D、三种晶体都为分子晶体,分子间作用力越大,物质的熔、沸点就越高,正确顺序应为SiH4>干冰>CH4,故D错误.
故选A.
点评 本题考查不同晶体熔沸点高低的比较,题目难度不大,注意同种晶体和不同晶体熔沸点高低比较的方法和角度.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
10.从理论上分析,关于Fe-CuSO4溶液-Cu原电池的叙述正确的是( )
| A. | 铜极为负极 | B. | 电子从铜沿导线转移到铁 | ||
| C. | 铁表面析出金属铜 | D. | 总反应为Fe+CuSO4=FeSO4+Cu |
20.图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是( )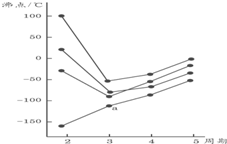

| A. | H2S | B. | CH4 | C. | PH3 | D. | SiH4 |
7.下列化学用语中正确的是( )
| A. | 乙烯的结构简式为CH2CH2 | B. | 羟基的电子式: | ||
| C. | 丁烯的键线式 | D. | 乙醇的分子式:CH3CH2OH |
4.下列化合物分子中的所有碳原子不能处于同一平面的是( )
| A. | 乙烯 | B. | 丙炔 | C. | 异戊烷 | D. | 对二甲苯 |
5.取四等份铝,分别加入足量的下列溶液中,充分反应后,放出氢气最多的是( )
| A. | 3 mol•L-1氨水 | B. | 4 mol•L-1 HNO3 | ||
| C. | 8 mol•L-1 NaOH | D. | 18 mol•L-1 H2SO4 |