题目内容
3.过氧化镁(MgO2)产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.已知过氧化镁与酸反应生成双氧水.(1)某研究小组通过下列方案测定样品中过氧化镁的含量:取一定量样品,加入足量稀盐酸,充分反应后再加入NaOH溶液调节pH至Mg2+沉淀完全,过滤、洗涤、灼烧,根据固体的质量进行计算.
已知Ksp[Mg(OH)2]=l×10-11.常温下为使Mg2+沉淀完全[使其浓度小于l×10-5mol/L],溶液的pH应调至11.
(2)实验室通过下列方案测定样品中过氧化镁的含量:称取0.1000g样品置于碘量瓶中,加入足量KI溶液和稀硫酸,摇匀后在暗处静置5min,然后用0.1000mol/L Na2S2O3的标准溶液滴定至终点,消耗溶液Na2S2O3 20.00mL.(已知:I2+2Na2S2O3═Na2S4O6+2NaI)
①滴定过程中若操作过慢,导致结果偏高(填偏高、偏低或无影响).
②滴定时选用的指示剂为淀粉.
③样品中过氧化镁的质量分数为56%(写计算过程).
分析 (1)根据氢氧化镁的溶度积,计算出溶液中氢氧根离子的浓度,求出溶液的PH;
(2)①滴定过程中若操作过慢,碘化钾中碘离子会被空气中的氧气氧化为碘单质;
②由于碘遇淀粉显蓝色,加入少量淀粉溶液作指示剂;
③加入0.1mol•L-1KI溶液的要使过氧化镁完全反应,根据电子守恒可知关系式MgO2~2KI,由于碘遇淀粉显蓝色,加入少量淀粉溶液作指示剂;根据电子守恒找出关系式MgO2~2KI~I2~2Na2S2O3,计算出过氧化镁的质量分数.
解答 解:(1)根据氢氧化镁的溶度积常数可知,当溶液中c(Mg2+)=l×10-5mol/L时,Ksp[Mg(OH)2]=1×10-11=c(Mg2+)•c2(OH-),溶液中OH-浓度等于1×10-3mol/L,所以溶液的pH=11;
故答案是:11;
(2)①滴定过程中若操作过慢,碘化钾中碘离子会被空气中的氧气氧化为碘单质,消耗标准溶液Na2S2O3的体积增大,依据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$分析,测定结构偏高,
故答案为:偏高;
②用0.1000mol/L Na2S2O3的标准溶液滴定至终点,发生反应I2+2Na2S2O3═Na2S4O6+2NaI,碘单质遇到淀粉变蓝色,当碘单质反应完,溶液蓝色变化为无色,
故答案为:淀粉;
③0.1000g样品置于碘量瓶中,假设样品中都是MgO2,则其物质的量为0.01mol,加入足量KI溶液和稀硫酸,要使过氧化镁完全反应,根据电子守恒可知关系式MgO2~2KI,由于碘遇淀粉显蓝色,加入少量淀粉溶液作指示剂,用0.1000mol•L-1Na2S2O3溶液滴定,滴定到终点时共消耗20mL,则Na2S2O3的物质的量为2×10-3mol,根据电子守恒找出关系式MgO2~2KI~I2~2Na2S2O3,计算出过氧化镁的物质的量为$\frac{1}{2}$×2×10-3mol=1×10-3mol,所以过氧化镁的质量分数为=$\frac{1×1{0}^{-3}mol×56g/mol}{0.1000g}$×100%=56%,
故答案为:56%.
点评 本题考查了溶度积常数的计算、滴定实验过程分析、误差判断和含量计算等知识点,滴定实验原理和氧化还原反应电子守恒是解题关键,题目难度中等.

(1)在热水浴中进行3个实验,部分实验报告如下表所示
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 在稀硫酸中加铜片 | 无明显变化 |
| Ⅱ | 在硝酸钠溶液中加入铜片 | 无明显变化 |
| Ⅲ | 在稀硫酸中加入硝酸钠溶液 | 无明显变化 |
| 再加入铜片 | 有无色气泡;溶液变蓝色 |
②实验Ⅲ中反应的本质是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(用离子方程式表示).
(2)甲同学提出:改变反应条件,可以实现金属铜和稀硫酸反应.
①将铜片放入盛有稀硫酸的烧杯中,不断向稀硫酸中加入过氧化氢并加热烧杯,发现铜片开始溶解,溶液逐渐变蓝色,过氧化氢在该实验中的作用是作氧化剂,将铜氧化为铜离子.
②利用电化学原理实现铜溶于稀硫酸并放出氢气.请画出简易装置图(标明电极,电解质溶液成分).
| A. | 铝与稀盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | NaOH与HCl的反应 |
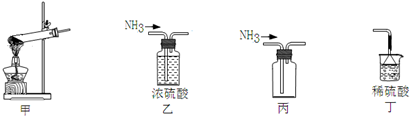
| A. | 用甲做发生装置 | B. | 用乙除去NH3中的杂质 | ||
| C. | 用丙来收集NH3 | D. | 用丁进行尾气处理并防止倒吸 |
| A. | KOH | B. | CH3COONa | C. | CuSO4 | D. | Na2CO3 |
| A. | 金刚石>NaCl>O2 | B. | F2>Cl2>Br2 | C. | S>NaBr>金刚石 | D. | SiH4<CH4<干冰 |
| A. |  | B. |  | C. |  | D. |  |

 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr;写出B盛AgNO3溶液的试管中所发生反应的化学方程式:HBr+AgNO3=AgBr↓+HNO3.
+HBr;写出B盛AgNO3溶液的试管中所发生反应的化学方程式:HBr+AgNO3=AgBr↓+HNO3.