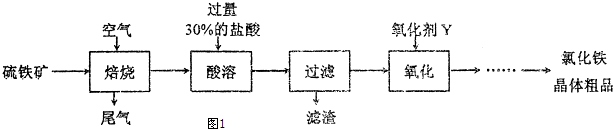
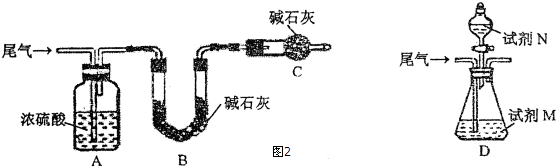
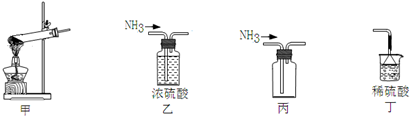
题目内容
6.实验测得,1g乙炔气体在25℃、101kPa下完全燃烧热时,放出热量50kJ.乙炔燃烧热的热化学方程式为:C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol.分析 燃烧热是指在25℃、101kPa下,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物的物质的量必须为1mol,产物必须为稳定氧化物,燃烧为放热,△H<0.
解答 解:1g乙炔气体在25℃、101kPa下完全燃烧热时,放出热量50kJ,1mol乙炔的质量为26g,26g乙炔完全燃烧放出热量为50kJ/g×26g=1300kJ,则乙炔燃烧热的热化学方程式为:C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol;
故答案为:C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol.
点评 本题考查燃烧热的热化学方程式的书写,题目难度不大,注意表示燃烧热的热化学方程式,可燃物为1mol,生成物为稳定的氧化物.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
8.下列叙述中正确的是( )
| A. | 聚乙烯、植物油都是混合物,都能使溴的四氯化碳溶液褪色 | |
| B. | 除去乙烷气体中少量的乙烯:可将气体通过盛有酸性KMnO4溶液的洗气瓶 | |
| C. | 将等体积的苯、汽油和水在试管中充分振荡后静置,现象为: | |
| D. | 可用灼烧的方法鉴别蛋白质和纤维素 |
14.下列反应既是氧化还原反应,又是放热反应的是( )
| A. | 铝与稀盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | NaOH与HCl的反应 |
1.下面的排序正确的是( )
| A. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| B. | 熔点由高到低:SiC>Si>SiO2>Ge | |
| C. | 沸点由高到低:NH3>PH3>AsH3>SbH3 | |
| D. | 晶格能由大到小:NaI>NaBr>NaCl>NaF |
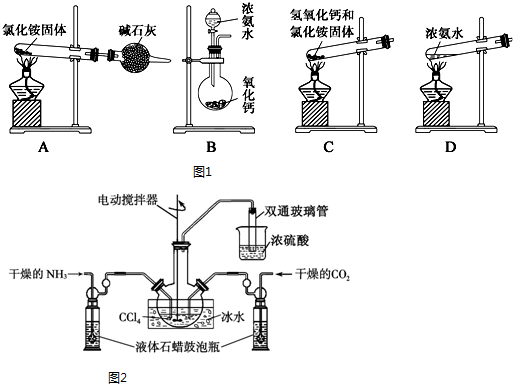
18.下列装置可用于NH4Cl固体和Ca(OH)2固体实验室制NH3的实验,能达到实验目的装置的是( )

| A. | 用甲做发生装置 | B. | 用乙除去NH3中的杂质 | ||
| C. | 用丙来收集NH3 | D. | 用丁进行尾气处理并防止倒吸 |
15.下列物质的熔、沸点高低顺序,正确的是( )
| A. | 金刚石>NaCl>O2 | B. | F2>Cl2>Br2 | C. | S>NaBr>金刚石 | D. | SiH4<CH4<干冰 |
16.下列关于原电池的叙述中正确的是( )
| A. | 正极和负极必须是两种不同的金属 | |
| B. | 电子流入的一极为正极 | |
| C. | 原电池工作时,正极和负极上发生的都是氧化还原反应 | |
| D. | 原电池工作时,实现了将电能转化为化学能 |