题目内容
5.取四等份铝,分别加入足量的下列溶液中,充分反应后,放出氢气最多的是( )| A. | 3 mol•L-1氨水 | B. | 4 mol•L-1 HNO3 | ||
| C. | 8 mol•L-1 NaOH | D. | 18 mol•L-1 H2SO4 |
分析 A、3mol/L氨水与铝不反应;
B、铝与4mol/L HNO3反应不放出氢气,放出NO2等气体;
C、铝与氢氧化钠的水溶液反应生成偏铝酸钠与氢气;
D、铝与浓硫酸发生钝化.
解答 解:A、3mol/L氨水与铝不反应,产生氢气量为0;
B、铝与4mol/L HNO3反应不放出氢气,放出NO2等气体,产生氢气量为0;
C、铝与氢氧化钠的水溶液反应生成偏铝酸钠与氢气;
D、铝与浓硫酸发生钝化,产生氢气量为0,
综上所述产生氢气最多的是C,
故选C.
点评 本题考查金属铝的性质,较易题,主要考查学生运用所学化学知识综合分析和解决实际问题的能力,该题溶液的浓度不是计算的数据,而是判断溶液属于“浓”或是“稀”,8mol/L以上的HCl、H2SO4、HNO3通常认为是浓酸,题目较简单.

练习册系列答案
相关题目
15.下列物质的熔、沸点高低顺序,正确的是( )
| A. | 金刚石>NaCl>O2 | B. | F2>Cl2>Br2 | C. | S>NaBr>金刚石 | D. | SiH4<CH4<干冰 |
16.下列关于原电池的叙述中正确的是( )
| A. | 正极和负极必须是两种不同的金属 | |
| B. | 电子流入的一极为正极 | |
| C. | 原电池工作时,正极和负极上发生的都是氧化还原反应 | |
| D. | 原电池工作时,实现了将电能转化为化学能 |
13.判断下列装置中,能构成原电池,有电流产生的是( )
| A. |  | B. |  | C. |  | D. |  |
20.600℃时,在一密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g)?2SO3(g);△H>0.反应过程中SO2、O2、SO3物质的量的变化如图所示,下列说法中不正确的是( )

| A. | .反应从0min开始,到第一次平衡时,二氧化硫的转化率为40% | |
| B. | 反应进行到10min至15min时,曲线发生变化可能是因为升高了温度 | |
| C. | 反应进行至20min时,曲线发生变化是因为通入了氧气 | |
| D. | 在15min~20min、25min~30min内时反应处于平衡状态 |
14.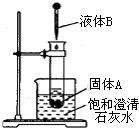 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入固体试剂A,再在试管中用滴管滴入5mL液体试剂B.可见到烧杯中饱和的澄清石灰水变浑浊.试回答下列问题:
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入固体试剂A,再在试管中用滴管滴入5mL液体试剂B.可见到烧杯中饱和的澄清石灰水变浑浊.试回答下列问题:
(1)试推测试剂A和B各是什么?(写出两组)
(2)解释烧杯中澄清石灰水变浑浊的原因:A与B反应放出热量,使烧杯中澄清的饱和石灰水温度升高,Ca(OH)2的溶解度随温度的升高而降低,因而析出Ca(OH)2沉淀,溶液变浑浊.
 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入固体试剂A,再在试管中用滴管滴入5mL液体试剂B.可见到烧杯中饱和的澄清石灰水变浑浊.试回答下列问题:
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入固体试剂A,再在试管中用滴管滴入5mL液体试剂B.可见到烧杯中饱和的澄清石灰水变浑浊.试回答下列问题:(1)试推测试剂A和B各是什么?(写出两组)
| 固体试剂A | 液体试剂B | |
| ① | ||
| ② |
15.今年入春以来,韩店雾霾天气频繁出现,空气质量很差,严重影响老百姓的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
根据表中数据判断PM25的酸碱性为酸性,试样的pH=4.
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+O2(g)=H2O(g)△H=-241.8kJ•mol-1
C(s)+O2(g)=CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是ab.
a.Ca(OH)2 b.Na2CO3 c.CaCl2d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移.
②目前,在汽车尾气系统中安装催化转化器可减少CO和NO的污染,反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+O2(g)=H2O(g)△H=-241.8kJ•mol-1
C(s)+O2(g)=CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是ab.
a.Ca(OH)2 b.Na2CO3 c.CaCl2d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6.汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移.
②目前,在汽车尾气系统中安装催化转化器可减少CO和NO的污染,反应方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
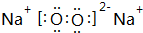 ,其中含有的化学键为离子键、共价键.
,其中含有的化学键为离子键、共价键.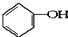 合成
合成 .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)
 、D
、D .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$