题目内容
10.从理论上分析,关于Fe-CuSO4溶液-Cu原电池的叙述正确的是( )| A. | 铜极为负极 | B. | 电子从铜沿导线转移到铁 | ||
| C. | 铁表面析出金属铜 | D. | 总反应为Fe+CuSO4=FeSO4+Cu |
分析 根据Fe+CuSO4═FeSO4+Cu结合原电池原理知,铁作负极,铜作正极,负极上失电子发生氧化反应;正极上得电子发生还原反应;电子从铁沿着导线流向Cu;Cu表明铜离子得到电子生成铜,据此进行解答.
解答 解:Fe-CuSO4溶液-Cu原电池的总反应为:Fe+CuSO4═FeSO4+Cu,
A.Fe活泼性大于Cu,则Fe为负极,Cu为正极,故A错误;
B.Fe为负极,电子从负极沿着导线流向铜,故B错误;
C.Fe失去电子生成亚铁离子,铜离子在正极Cu上得到电子生成铜,Cu表明析出铜,故C错误;
D.该原电池的总反应为:Fe+CuSO4═FeSO4+Cu,故D正确;
故选D.
点评 本题考查了原电池工作原理及其应用,题目难度中等,明确原电池工作原理为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
1.下面的排序正确的是( )
| A. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| B. | 熔点由高到低:SiC>Si>SiO2>Ge | |
| C. | 沸点由高到低:NH3>PH3>AsH3>SbH3 | |
| D. | 晶格能由大到小:NaI>NaBr>NaCl>NaF |
18.下列装置可用于NH4Cl固体和Ca(OH)2固体实验室制NH3的实验,能达到实验目的装置的是( )
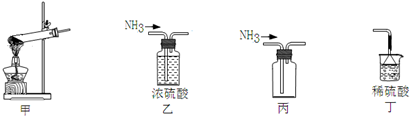

| A. | 用甲做发生装置 | B. | 用乙除去NH3中的杂质 | ||
| C. | 用丙来收集NH3 | D. | 用丁进行尾气处理并防止倒吸 |
15.下列物质的熔、沸点高低顺序,正确的是( )
| A. | 金刚石>NaCl>O2 | B. | F2>Cl2>Br2 | C. | S>NaBr>金刚石 | D. | SiH4<CH4<干冰 |
19.对于反应A2+B2=2AB来说,下列速率表示该反应最快的是( )
| A. | V(B2)=0.2mol/(L•S) | B. | V(A2)=6mol/(L•min) | ||
| C. | V(AB)=8mol/(L•min) | D. | V(B2)=1.2mol/(L•min) |
20.600℃时,在一密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g)?2SO3(g);△H>0.反应过程中SO2、O2、SO3物质的量的变化如图所示,下列说法中不正确的是( )

| A. | .反应从0min开始,到第一次平衡时,二氧化硫的转化率为40% | |
| B. | 反应进行到10min至15min时,曲线发生变化可能是因为升高了温度 | |
| C. | 反应进行至20min时,曲线发生变化是因为通入了氧气 | |
| D. | 在15min~20min、25min~30min内时反应处于平衡状态 |
 .
.