题目内容
20.图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是( )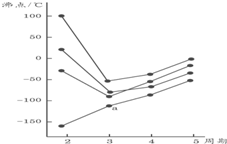
| A. | H2S | B. | CH4 | C. | PH3 | D. | SiH4 |
分析 根据氢化物的相对分子质量越大,物质熔沸点越高,分子间含有氢键的熔沸点反常,据此分析.
解答 解:在ⅣA~ⅦA中的氢化物里,相对分子质量越大,物质熔沸点越高,NH3、H2O、HF因存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象,故a点代表的应是SiH4.
故选D.
点评 本题考查了氢键的存在对物质性质的影响,侧重考查学生对一般规律中异常现象的辨别能力,题目难度不大.

练习册系列答案
相关题目
10.现用浓度为0.1000mol/L的HCl溶液,测定某未知浓度的NaOH溶液:
(1)除锥形瓶外,下列实验仪器中不需要的是C.
A.滴定管B.铁架台C.容量瓶D.滴定管夹
(2)在锥形瓶中放入一定量的NaOH溶液,加入甲基橙或酚酞作为指示剂;当滴定达到终点后,蓝线的凹液面的最低点所对应的刻度即为终读数.
(3)填写下表中的空白处
(4)四组数据中,误差较大的是第1组,造成这种结果的原因可能是B.
A.滴定管未用HCl溶液润洗
B.摇晃锥形瓶时,有液体溅出
C.滴定前装HCl的滴定管下端有气泡,滴定后气泡消失
D.放入NaOH溶液前,锥形瓶内有水
(5)计算NaOH浓度平均值:0.1066mol/L.
(1)除锥形瓶外,下列实验仪器中不需要的是C.
A.滴定管B.铁架台C.容量瓶D.滴定管夹
(2)在锥形瓶中放入一定量的NaOH溶液,加入甲基橙或酚酞作为指示剂;当滴定达到终点后,蓝线的凹液面的最低点所对应的刻度即为终读数.
(3)填写下表中的空白处
| 实验次数 | V(NaOH) | V(HCl)/mL | c(NaOH) | ||
| ml | 初读数 | 终读数 | 体积 | mol/L | |
| 1 | 16.00 | 0.00 | 16.70 | 16.70 | 0.1044 |
| 2 | 16.75 | 0.00 | 17.85 | 17.85 | |
| 3 | 19.55 | 0.00 | 20.80 | 20.80 | 0.1064 |
| 4 | 15.00 | 0.00 | 16.00 | 16.00 | 0.1067 |
A.滴定管未用HCl溶液润洗
B.摇晃锥形瓶时,有液体溅出
C.滴定前装HCl的滴定管下端有气泡,滴定后气泡消失
D.放入NaOH溶液前,锥形瓶内有水
(5)计算NaOH浓度平均值:0.1066mol/L.
8.10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是( )
| A. | KOH | B. | CH3COONa | C. | CuSO4 | D. | Na2CO3 |
15.下列物质的熔、沸点高低顺序,正确的是( )
| A. | 金刚石>NaCl>O2 | B. | F2>Cl2>Br2 | C. | S>NaBr>金刚石 | D. | SiH4<CH4<干冰 |
5.下列叙述中,正确的是( )
| A. | 两种粒子,若核外电子排布完全相同,则其化学性质相同 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 一种微粒与另一种微粒的质子数和电子数均相等,它们可能是一种离子和一种分子 | |
| D. | 不存在两种质子数和电子数均相同的阳离子和阴离子 |

 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr;写出B盛AgNO3溶液的试管中所发生反应的化学方程式:HBr+AgNO3=AgBr↓+HNO3.
+HBr;写出B盛AgNO3溶液的试管中所发生反应的化学方程式:HBr+AgNO3=AgBr↓+HNO3. 下面给出了四种烃A、B、C、D的相关信息:
下面给出了四种烃A、B、C、D的相关信息: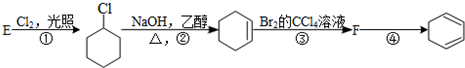
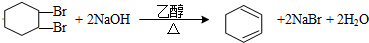 .
.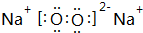 ,其中含有的化学键为离子键、共价键.
,其中含有的化学键为离子键、共价键.