题目内容
2.近几年来,我国许多城市多次出现雾挂天气.改善空气质量保持空气清新营造健康舒适的生存环境已成为全人类的共识.①空气污染指数是根据空气中二氧化硫、氮氧化物和可吸人颗粒(主要是PM2.5 )等污物的浓度计算出来的数值.
②下列行为能缓解城市大气中PM2.5浓度的是B (填字母).
A.燃放烟花爆竹 B.为城市主干道洒水保洁 C.大面积开发土建项目
B.燃煤气化有助于减少PM2.5,写出焦炭与水蒸气反应的化学方程式C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
分析 目前计入空气污染指数的项目暂定为:二氧化硫、氮氧化物、可吸入颗粒物和臭氧等;
A、燃放烟花爆竹由于火药爆炸产生大量的烟尘;B、为城市主干道洒水保洁使空气中的粉尘吸水后变大而降到地面;C、大面积开发土建项目会引起扬尘;
焦炭与水反应生成一氧化碳和氢气.
解答 解:①空气污染指数是根据空气中二氧化硫、氮氧化物和可吸人颗粒(主要是PM2.5 )等污物的浓度计算出来的数值;
A、燃放烟花爆竹由于火药爆炸产生大量的烟尘,故a不选;
B、为城市主干道洒水保洁使空气中的粉尘吸水后变大而降到地面,故b选;
C、大面积开发土建项目会引起扬尘,故c不选;
故选b;
故答案为:氮氧化物;B;
②焦炭与水反应生成一氧化碳和氢气,化学方程式:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2;
故答案为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2;
点评 本题考查了环境污染与保护,化学方程式的书写,明确空气污染指数项目及PM2.5概念是解题关键,题目难度不大.

练习册系列答案
相关题目
13.下列说法正确的是( )
| A. | 在NaHS溶液中滴入少量的CuCl2溶液产生黑色沉淀,HS-电离程度增大,反应后溶液pH减小 | |
| B. | 浑浊的苯酚试液中加入饱和Na2CO3溶液变澄清,则酸性:苯酚>碳酸 | |
| C. | 在等浓度NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl,则Ksp(AgCl)<Ksp(Ag2CrO4) | |
| D. | 等体积、物质的量浓度的HA与NaA(HA为弱酸)混合溶液,其酸碱性取决于Ka(HA)的大小 |
10.已知2mol H2(g)燃烧生成液态水放出的热量为571.6lkJ,而2molH2 (g)完全燃烧生成气态水放的热量为483.6kJ.下列说法正确的是( )
| A. | l molH2O (I)变成lmolH2O (g),向外界释放能量 | |
| B. | 1molH2O (g)分解成H2(g)和O2(g),吸收241. 8kJ能量 | |
| C. | 2mol H2(g)和l mol O2(g)的总能量小于2molH2O(1)的能量 | |
| D. | 断裂2molH2O (g)中所有的O-H键,吸收483.6 kJ能量 |
17.我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应为:4Al+3O2+6H2O=4A1(OH)3,下列判断错误的是( )
| A. | 铂电极做成网状,可增大与氧气的接触面积 | |
| B. | 该电池通常只需要更换铝板就可继续使用 | |
| C. | 海洋电池中铝板充当负极,发生氧化反应 | |
| D. | 负极反应为:O2+H20+2e-=2OH- |
7.(1)氯碱工业是利用电解食盐水生产烧碱、氯气为基础的工业体系.
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,下列加入顺序合理的是D.
A.碳酸钠、氢氧化钠、氯化钡B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡D.氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”.某工厂的盐泥组成如下:
为生产七水硫酸镁,设计了以下工艺流程:

生产七水硫酸镁工艺流程图
1-反应器 2-过滤器 3-蒸发浓缩器 4-结晶槽 5-洗涤槽 6-真空干燥器
装置1中加入的酸应选用硫酸,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右.持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4.其中碳酸钙可以转化为硫酸钙的原因是使平衡CaCO3+H2SO4?CaSO4+H2CO3(H2O+CO2↑)不断向右移动.
装置2中滤渣的主要成分为CaSO4、BaSO4、其它不溶物质.
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是NaCl.
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是防止失去结晶水.
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,下列加入顺序合理的是D.
A.碳酸钠、氢氧化钠、氯化钡B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡D.氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”.某工厂的盐泥组成如下:
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶于酸的物质 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |

生产七水硫酸镁工艺流程图
1-反应器 2-过滤器 3-蒸发浓缩器 4-结晶槽 5-洗涤槽 6-真空干燥器
装置1中加入的酸应选用硫酸,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右.持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4.其中碳酸钙可以转化为硫酸钙的原因是使平衡CaCO3+H2SO4?CaSO4+H2CO3(H2O+CO2↑)不断向右移动.
装置2中滤渣的主要成分为CaSO4、BaSO4、其它不溶物质.
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是NaCl.
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是防止失去结晶水.
11.用石墨电极电解NaCl和CuSO4的混合溶液,开始时和一段时间后阴极析出的物质依次是( )
| A. | H2和Cl2 | B. | Cu和 O2 | C. | H2和Na | D. | Cu 和 H2 |

 的系统名称是3,4-二甲基-3-乙基己烷.
的系统名称是3,4-二甲基-3-乙基己烷. .
. 形成该高聚物的单体的结构简式分别为
形成该高聚物的单体的结构简式分别为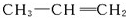 、
、 .
.