题目内容
20.甲同学对Cl2与FeCl2和KSCN混合溶液的反应进行如下实验探究.请回答下列问题:| 操作 | 现象 |
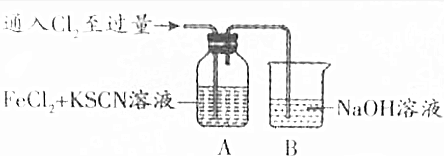 | Ⅰ.装置A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
(2)装置A中溶液变红的原因是2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3(用离子方程式表示).
(3)为了探究现象Ⅱ的原因,甲同学进行如下实验:取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为
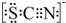
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取装置A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素(填名称).
③通过实验证明了SCN-中氮元素转化为NO3-,则SCN-与Cl2反应生成1mol CO2,转移电子的物质的量是16mol.
④(SCN)2的性质与卤素单质相似,并且还原性按Br-<SCN-<I-的混合溶液中,反应的离子方程式为(SCN)2+2I-=I2+2SCN-.
分析 (1)B装置是用来吸收氯气尾气的,根据元素守恒和电荷守恒可以写出离子方程式;
(2)Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化铁溶液,呈红色,据此答题;
(3)①根据SCN-的电子式为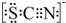 可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,不能再被氧化了,据此答题;
可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,不能再被氧化了,据此答题;
②加入用盐酸酸化的BaCl2溶液,产生白色沉淀,说明白色沉淀为硫酸钡,即溶液中有硫酸根离子,其中硫显+6价,而原来SCN-中硫显-2价,所以被氧化的元素为硫元素;
③SCN-与Cl2反应的化学方程式可以计算出电子转移的物质的量;
④还原性按Br-<SCN-<I-的混合溶液中加入(SCN)2,和碘离子反应生成碘单质.
解答 解:(1)B装置是用来吸收氯气尾气的,根据元素守恒和电荷守恒可以写出离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(2)Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化铁溶液,呈红色,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3,
故答案为:2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3;
(3)①根据SCN-的电子式为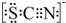 可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,不能再被氧化了,
可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,不能再被氧化了,
故答案为:SCN-中的碳元素是最高价态+4价;
②加入用盐酸酸化的BaCl2溶液,产生白色沉淀,说明白色沉淀为硫酸钡,即溶液中有硫酸根离子,其中硫显+6价,而原来SCN-中硫显-2价,所以被氧化的元素为硫元素,故答案为:硫元素;
③SCN-与Cl2反应生成硫酸根和硝酸根还有二氧化碳,所以它们反应的化学方程式为:SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+,此反应中电子转移数目为16,即由方程式可知每生成1mol二氧化碳要转移16mol电子,故答案为:16;
④还原性按Br-<SCN-<I-的混合溶液中加入(SCN)2,和碘离子反应生成碘单质,反应的离子方程式为:(SCN)2+2I-=I2+2SCN-,
故答案为:(SCN)2+2I-=I2+2SCN-.
点评 本题是实验方案的综合题,综合性较强,其中涉及到了离子的检验、氧化还原的离子方程式的书写、实验步骤的设计、化学计算等知识点,解题的关键是要掌握元素化合物的基础知识及实验基本操作要求.

| A. | Na+、Cu2+、Cl-、CO32- | B. | HCO3-、Cl-、Fe3+、Na+ | ||
| C. | Cl-、K+、NO3-、Fe2+、 | D. | S2-、SO42-、NH4+、Fe2+ |
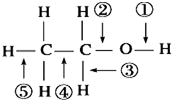
| A. | 乙醇与钠反应,键①断裂 | |
| B. | 乙醇在Ag催化作用下与O2反应,键①③断裂 | |
| C. | 乙醇完全燃烧时,只有①②键断裂 | |
| D. | 乙醇与氢卤酸反应,键②断裂 |
| A. | 1mol/LBaCl2溶液中含有的Ba2+数为NA | |
| B. | 1mol镁离子中含有的电子数为2NA | |
| C. | 常温常压下,11.2LH2中含有H2数为0.5NA | |
| D. | 16gO3中含有氧原子数为NA |
| A. | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来,金属铝的熔点较低 | |
| B. | 铝与Fe2O3发生铝热反应后固体的质量不变 | |
| C. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | Al、HCl、NaOH中任意两种物质在一定条件下均能发生反应 |
| A. | 1molNa被完全氧化生成Na2O2时失去2mole- | |
| B. | Na2O2常用作呼吸面具的供氧剂,使用过程中涉及氧化还原反应 | |
| C. | 热稳定性:NaHCO3>Na2CO3 | |
| D. | 纯碱是面包发酵粉和碱性洗涤剂的主要成分之一 |
| A. | K+、Cl-、NO3-、HCO3- | B. | K+、Fe2+、I-、NO3- | ||
| C. | Na+、Cl-、NO3-、SO42- | D. | Al3+、AlO2-、Cl-、HS- |
 某有机物的结构简式如图所示试回答:
某有机物的结构简式如图所示试回答: +H2↑.
+H2↑. +2H2O.
+2H2O.