题目内容
15.汽车尾气中的NOx是大气污染物之一,科学家们在尝试用更科学的方法将NOx转化成无毒物质,从而减少汽车尾气污染.压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2.①CH4(g)+4NO2(g)?催化剂 4NO(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+4NO(g)?催化剂 2N2(g)+CO2(g)+2H2O(g)△H2<0
③CH4(g)+2NO2(g)?催化剂 N2(g)+CO2(g)+2H2O(g)△H3=△H1+△H2(用△H1和△H2表示)
分析 ①CH4(g)+4NO2(g)$\frac{\underline{\;催化剂\;}}{\;}$ 4NO(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+4NO(g)$\frac{\underline{\;催化剂\;}}{\;}$ 2N2(g)+CO2(g)+2H2O(g)△H2<0
依据热化学方程式和盖斯定律计算,①+②得到所需热化学方程式.
解答 解:①CH4(g)+4NO2(g)$\frac{\underline{\;催化剂\;}}{\;}$4NO(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+4NO(g)$\frac{\underline{\;催化剂\;}}{\;}$2N2(g)+CO2(g)+2H2O(g)△H2<0
依据盖斯定律计算①+②得到反应③的热化学方程式为:
CH4(g)+2NO2(g)$\frac{\underline{\;催化剂\;}}{\;}$N2(g)+CO2(g)+2H2O(g)△H3=△H1+△H2,
故答案为:△H1+△H2.
点评 本题考查了热化学方程式和盖斯定律的计算应用,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
20.甲同学对Cl2与FeCl2和KSCN混合溶液的反应进行如下实验探究.请回答下列问题:
(1)装置B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(2)装置A中溶液变红的原因是2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3(用离子方程式表示).
(3)为了探究现象Ⅱ的原因,甲同学进行如下实验:取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为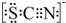
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取装置A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素(填名称).
③通过实验证明了SCN-中氮元素转化为NO3-,则SCN-与Cl2反应生成1mol CO2,转移电子的物质的量是16mol.
④(SCN)2的性质与卤素单质相似,并且还原性按Br-<SCN-<I-的混合溶液中,反应的离子方程式为(SCN)2+2I-=I2+2SCN-.
| 操作 | 现象 |
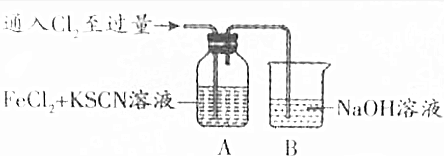 | Ⅰ.装置A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
(2)装置A中溶液变红的原因是2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3(用离子方程式表示).
(3)为了探究现象Ⅱ的原因,甲同学进行如下实验:取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为
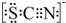
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取装置A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素(填名称).
③通过实验证明了SCN-中氮元素转化为NO3-,则SCN-与Cl2反应生成1mol CO2,转移电子的物质的量是16mol.
④(SCN)2的性质与卤素单质相似,并且还原性按Br-<SCN-<I-的混合溶液中,反应的离子方程式为(SCN)2+2I-=I2+2SCN-.
4.KNO3固体中混有Ba(NO3)2,现欲得到纯净的KNO3固体,下列措施合理的是( )
| A. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}SO_{4}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| B. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}CO_{3}溶液}$$\stackrel{过滤}{→}$滤液$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| C. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}CO_{3}溶液}$$\stackrel{过滤}{→}$滤液$→_{足量}^{HNO_{3}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| D. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}SO_{4}溶液}$$\stackrel{过滤}{→}$滤液$→_{足量}^{HNO_{3}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 |
5.下列有关实验原理或实验操作正确的是( )
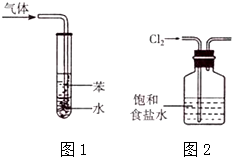

| A. | 用pH试纸测量新制氯水的pH | |
| B. | 用量筒量取 20mL 0.5000mol•L-1 H2SO4溶液于烧杯中,加水80mL,配制成0.1000mol•L-1H2SO4溶液 | |
| C. | 图1所示装置可用于吸收NH3或HC1气体,并防止倒吸 | |
| D. | 实验室用图2所示装置除去Cl2中的少量HC1 |
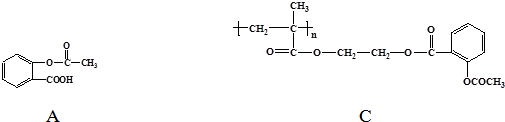
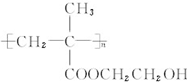 .
.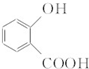 和CH3COOH(写结构简式).
和CH3COOH(写结构简式).
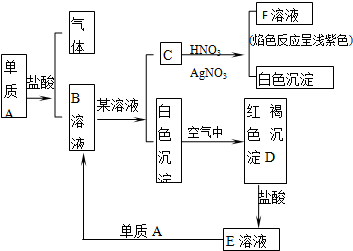
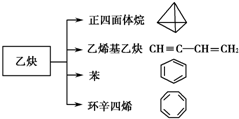 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物. .
. 、
、 .
.