题目内容
8.下列关于乙醇在各种反应中断裂键的说法不正确的是( )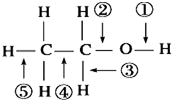
| A. | 乙醇与钠反应,键①断裂 | |
| B. | 乙醇在Ag催化作用下与O2反应,键①③断裂 | |
| C. | 乙醇完全燃烧时,只有①②键断裂 | |
| D. | 乙醇与氢卤酸反应,键②断裂 |
分析 乙醇含有-OH,可发生取代、氧化和消去反应,可与钠反应,结合官能团的性质判断可能的共价键的断裂方式,以此解答.
解答 解:A.乙醇与与金属钠反应生成乙醇钠和氢气,断开的羟基上的氢氧键,即①断裂,故A正确;
B.乙醇在银催化下与O2反应生成乙醛和水,断开的是羟基上的氢氧键和与羟基所连的碳的氢,即①③断裂,故B正确;
C.在空气中完全燃烧时生成二氧化碳和水,断裂①②③④⑤,故C错误;
D.乙醇与氢卤酸反应生成卤代烃,键②断裂,故D正确.
故选C.
点评 本题考查有机物乙醇的结构和性质,侧重于学生的分析能力的考查,有机物断键部位为有机反应的灵魂,注意把握乙醇的官能团的性质和结构特点,题目难度不大.

练习册系列答案
相关题目
20.甲同学对Cl2与FeCl2和KSCN混合溶液的反应进行如下实验探究.请回答下列问题:
(1)装置B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(2)装置A中溶液变红的原因是2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3(用离子方程式表示).
(3)为了探究现象Ⅱ的原因,甲同学进行如下实验:取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为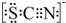
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取装置A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素(填名称).
③通过实验证明了SCN-中氮元素转化为NO3-,则SCN-与Cl2反应生成1mol CO2,转移电子的物质的量是16mol.
④(SCN)2的性质与卤素单质相似,并且还原性按Br-<SCN-<I-的混合溶液中,反应的离子方程式为(SCN)2+2I-=I2+2SCN-.
| 操作 | 现象 |
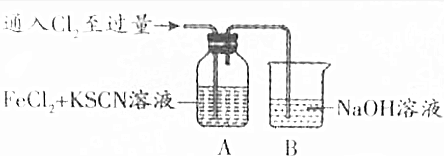 | Ⅰ.装置A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
(2)装置A中溶液变红的原因是2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3(用离子方程式表示).
(3)为了探究现象Ⅱ的原因,甲同学进行如下实验:取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为
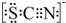
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取装置A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素(填名称).
③通过实验证明了SCN-中氮元素转化为NO3-,则SCN-与Cl2反应生成1mol CO2,转移电子的物质的量是16mol.
④(SCN)2的性质与卤素单质相似,并且还原性按Br-<SCN-<I-的混合溶液中,反应的离子方程式为(SCN)2+2I-=I2+2SCN-.
4.KNO3固体中混有Ba(NO3)2,现欲得到纯净的KNO3固体,下列措施合理的是( )
| A. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}SO_{4}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| B. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}CO_{3}溶液}$$\stackrel{过滤}{→}$滤液$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| C. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}CO_{3}溶液}$$\stackrel{过滤}{→}$滤液$→_{足量}^{HNO_{3}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| D. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}SO_{4}溶液}$$\stackrel{过滤}{→}$滤液$→_{足量}^{HNO_{3}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 |
 $→_{FeCl_{3}}^{Cl_{2}}$分离得A$→_{过氧化苯甲酰}^{NBS}$
$→_{FeCl_{3}}^{Cl_{2}}$分离得A$→_{过氧化苯甲酰}^{NBS}$ $\stackrel{NaCN}{→}$B$→_{50%NaOH}^{CH_{3}CHClCH_{3}}$
$\stackrel{NaCN}{→}$B$→_{50%NaOH}^{CH_{3}CHClCH_{3}}$ $→_{②SOCl_{2}}^{①H+}$C
$→_{②SOCl_{2}}^{①H+}$C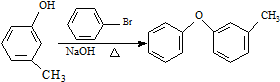 $→_{Co(OAc)_{2}}^{O_{2}}$
$→_{Co(OAc)_{2}}^{O_{2}}$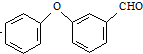 $→_{H+}^{NaCN}$D
$→_{H+}^{NaCN}$D +HCl
+HCl 中的官能团有醚键和醛基(填名称).
中的官能团有醚键和醛基(填名称).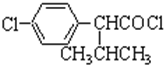 ;合成3中的有机反应类型为取代反应.
;合成3中的有机反应类型为取代反应. .
. )合成一种抗早产药的重要中间体.根据已有知识并结合相关信息,写出以CH3Br和
)合成一种抗早产药的重要中间体.根据已有知识并结合相关信息,写出以CH3Br和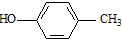 为有机原料(无机试剂和反应条件任选)合成E的路线流程图.合成路线流程图示例如下:CH2═CH2$→_{催化剂}^{O_{2}}$CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH.
为有机原料(无机试剂和反应条件任选)合成E的路线流程图.合成路线流程图示例如下:CH2═CH2$→_{催化剂}^{O_{2}}$CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH.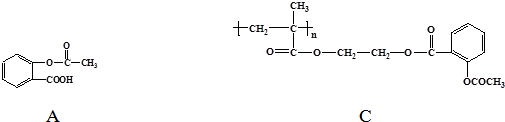
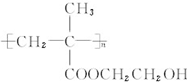 .
.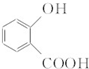 和CH3COOH(写结构简式).
和CH3COOH(写结构简式).


 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.