题目内容
16. 如图为KNO3和NaCl的溶解度曲线,请回答下列问题:
如图为KNO3和NaCl的溶解度曲线,请回答下列问题:(1)20℃时,KNO3的溶解度为31.6g.
(2)a点处KNO3和NaCl两种溶液中溶质的质量分数相等(填“相等”或“不相等”)
(3)若固体KNO3中混有的少量NaCl,可采用降温结晶(填“蒸发结晶”或“降温结晶“)的方法提纯.
(4)40℃时,将35.0gNaCl溶于100g水中,降温至0℃时,可析出晶体0g.
分析 (1)根据图示分析20℃时,KNO3的溶解度;
(2)a点处KNO3和NaCl的溶解度相同;
(3)KNO3的溶解度随着温度的变化较大,而NaCl的溶解度随着温度的变化几乎不变;
(4)在0℃时,氯化钠的溶解度大于35g.
解答 解:(1)根据图示可知20℃时,KNO3的溶解度为31.6g,故答案为:31.6g;
(2)a点处KNO3和NaCl的溶解度相同,即在100g水中所溶解的两者的质量相同,故所得溶液的质量分数相同,故答案为:相同;
(3)KNO3的溶解度随着温度的变化较大,而NaCl的溶解度随着温度的变化几乎不变,故若固体KNO3中混有的少量NaCl,可采用降温结晶的方法分离出硝酸钾从而达到提纯的目的,故答案为:降温结晶;
(4)由于在40℃时,氯化钠的溶解度大于35g,故将35.0gNaCl溶于100g水中,所得的溶液为不饱和溶液;而0℃时,氯化钠的溶解度仍大于35g,故将此溶液降温至0℃时,不能析出晶体,故答案为:0.
点评 明确饱和溶液和不饱和溶液的转化、硝酸钾和氯化钠的溶解度随温度的变化特点和溶质的质量分数计算等,才能结合具体情境分析解答.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
6.实验室保存下列试剂的方法不正确的是( )
| A. | 钠保存在煤油中 | |
| B. | 保存碱性溶液的试剂瓶的瓶塞要用橡胶塞 | |
| C. | 硝酸保存到棕色的试剂瓶中,并放置在冷暗处 | |
| D. | 氢氟酸保存到玻璃试剂瓶中 |
7.下列关于硝酸的认识中,正确的是( )
| A. | 浓硝酸在常温下光照和受热都会分解 | |
| B. | 浓硝酸与金属反应不放出氢气,而稀硝酸与金属反应可置换出氢气 | |
| C. | 常温下,因为铝和铁不与浓硝酸反应,所以浓硝酸可盛放在铝制或铁制容器中 | |
| D. | 铜分别与浓硝酸、稀硝酸反应生成NO2和NO,故稀硝酸的氧化性大于浓硝酸 |
4.下列物质在水溶液中的电离方程式书写不正确的是( )
| A. | NaHCO3=Na++H++CO32- | B. | Cu(OH)2?Cu2++2OH- | ||
| C. | CH3COONH4=CH3COO-+NH4+ | D. | H2S?H++HS- |
11.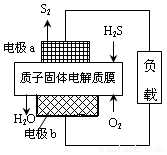 工业废气H2S经资源化利用后可回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1.H2S燃料电池的工作原理如图所示.下列说法不正确的是( )
工业废气H2S经资源化利用后可回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1.H2S燃料电池的工作原理如图所示.下列说法不正确的是( )
 工业废气H2S经资源化利用后可回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1.H2S燃料电池的工作原理如图所示.下列说法不正确的是( )
工业废气H2S经资源化利用后可回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1.H2S燃料电池的工作原理如图所示.下列说法不正确的是( )| A. | 电极a为电池的正极 | |
| B. | 电极b上发生的电极反应为O2+4H++4e-=2H2O | |
| C. | 若电路中通过2mol电子,则电池内部释放632kJ热能 | |
| D. | 若有17gH2S参与反应,则会有1molH+经质子膜进入正极区 |
1.NaCl是一种基础化工原料,通过电解饱和食盐水可以制得NaOH、H2、Cl2.完成下列填空:
(1)写出电解饱和食盐水的化学方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(2)氯原子的最外层电子排布式为3S23P5,氯离子核外有18种运动状态不同的电子.
(3)氯气压缩成为液氯属于物理变化(选填“物理”“化学”).常用浓氨水来检查输氯管道是否泄漏,泄漏处会观察到大量的白烟(NH4Cl),还生成一种无色无味的单质气体,写出此反应的化学方程式并标出电子转移的方向和数目 .
.
(4)氯气可用来标定碘水中碘单质的含量:5Cl2+I2+6H2O→10HCl+2HIO3.测定时可用气体流量计准确控制氯气的体积,以淀粉做指示剂来指示反应终点,反应终点时的现象是溶液由蓝色逐渐变为无色,且在半分钟内不变色.
用氯气标定一定体积碘水中碘单质的浓度,进行三次平行实验,数据记录见表:
则上述碘水中碘单质的浓度为1×10-3mol/L,假定碘水的实际浓度为1.02×10-3 mol/L,则实验的相对误差为-1.96%(保留两位小数).
(1)写出电解饱和食盐水的化学方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(2)氯原子的最外层电子排布式为3S23P5,氯离子核外有18种运动状态不同的电子.
(3)氯气压缩成为液氯属于物理变化(选填“物理”“化学”).常用浓氨水来检查输氯管道是否泄漏,泄漏处会观察到大量的白烟(NH4Cl),还生成一种无色无味的单质气体,写出此反应的化学方程式并标出电子转移的方向和数目
 .
.(4)氯气可用来标定碘水中碘单质的含量:5Cl2+I2+6H2O→10HCl+2HIO3.测定时可用气体流量计准确控制氯气的体积,以淀粉做指示剂来指示反应终点,反应终点时的现象是溶液由蓝色逐渐变为无色,且在半分钟内不变色.
用氯气标定一定体积碘水中碘单质的浓度,进行三次平行实验,数据记录见表:
| 碘水的体积(mL) | 标况下氯气的体积(mL) |
| 500 | 56 |
| 500 | 55 |
| 500 | 57 |
2.下列离子方程式书写正确的是( )
| A. | 将Na投入CH3COOH中:2Na+2H+═2Na++H2↑ | |
| B. | 将过量氨水加入到AlCl3溶液中:Al3++4OH-═AlO2-+2H2O | |
| C. | 向氯化银悬浊液中加入溴化钾溶液:Ag++Br-═AgBr↓ | |
| D. | 碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
19.将下列物质按酸、碱、盐分类依次排列正确的是( )
| A. | 硫酸、纯碱、石灰石 | B. | 氢硫酸、烧碱、绿矾 | ||
| C. | 石炭酸、熟石膏、醋酸钠 | D. | 磷酸、乙醇钠、苛性钾 |
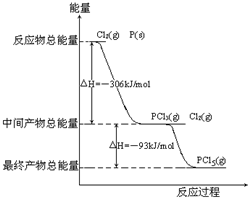 红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据如图回答下列问题:
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据如图回答下列问题: