题目内容
20. 红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据如图回答下列问题:
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据如图回答下列问题:(1)P和Cl2反应生成PCl3的热化学方程式:P(s)+$\frac{3}{2}$Cl2(g)═PCl3(g)△H=-306kJ•mol-1;
(2)PCl5分解生成PCl3和Cl2的热化学方程式:PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1;
(3)P和Cl2分两步反应生成1mol PCl5的△H1=-399kJ•mol-1;P和Cl2一步反应生成1mol PCl5的|△H2|=|△H1|(填>、<、=).
分析 根据反应物的总能量、中间产物的总能量以及最终产物的总能量分析,结合化学方程式以及热化学方程式的书写方法解答,注意盖斯定律的应用.
(1)P和Cl2反应生成PCl3的反应过程中反应焓变为-306KJ/mol,结合热化学方程式书写方法写出;
(2)由图象可知,1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量,以此可书写热化学方程式;
(3)依据盖斯定律反应焓变和起始和终了物质有关,与变化过程无关计算分析.
解答 解:(1)由图象可知,1molP与Cl2反应生成1molPCl3放出306kJ的能量,
则反应的热化学方程式为P(s)+$\frac{3}{2}$Cl2(g)═PCl3(g);△H=-306kJ•mol-1,
故答案为:P(s)+$\frac{3}{2}$Cl2(g)═PCl3(g)△H=-306kJ•mol-1;
(2)由图象可知,1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量,
则反应的热化学方程式为PCl5(g)═PCl3(g)+Cl2(g);△H=+93kJ•mol-1,
故答案为:PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1;
(3)由图象可知,P和Cl2分两步反应生成1molPCl5的△H1=-306kJ/mol-(+93kJ/mol)=-399kJ/mol,根据盖斯定律可知,反应无论一步完成还是分多步完成,生成相同的产物,反应热相等,则P和Cl2一步反应生成1molPCl5的反应热等于P和Cl2分两步反应生成1molPCl5的反应热,
故答案为:-399kJ•mol-1;=.
点评 本题考查较为综合,多角度考查反应热和化学方程式的书写等知识,为高考常见题型,侧重于学生的分析、计算能力的考查,题目难度中等.

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案| A. | 4Fe+3O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | |
| B. | Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | Fe+4HNO3(稀)═Fe(NO3)2+2NO2↑+2H2O | |
| D. | 2Fe2++4Br-+3Cl2(少量)═2Fe3++2Br2+6Cl- |
| A. | 用食醋除去水壶内的水垢:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 纯碱溶液呈碱性的原因是:CO32-+2H2O?H2CO3+2OH- | |
| C. | 钢铁发生吸氧腐蚀的正极反应式:O2+4e-+2H2O═4OH- | |
| D. | 表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
| A. | 2H2O+2e-═H2↑+2OH- | B. | O2+2H2O+4e-═4OH- | ||
| C. | Fe-2e-═Fe2+ | D. | 4OH--4e-═2H2O+O2↑ |
| A. | 蛋白质含量高食品 | B. | 葡萄糖含量高食品 | ||
| C. | 油脂含量高食品 | D. | 维生素含量高食品 |
| A. | 油脂皂化反应得到高级脂肪酸盐与甘油 | |
| B. | 在一定条件下,苯分别与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应 | |
| C. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| D. | 聚合物 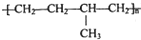 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |
| A. | +45.2 kJ•mol-1 | B. | -45.2 kJ•mol-1 | C. | +69.4 kJ•mol-1 | D. | -69.4 kJ•mol-1 |
 如图为KNO3和NaCl的溶解度曲线,请回答下列问题:
如图为KNO3和NaCl的溶解度曲线,请回答下列问题: