题目内容
19.向100mL 1mol/L的FeCl3溶液中,加入mg的铁粉完全反应后,测得溶液中Fe2+与Fe3+浓度之比为2:1(加入铁粉后,溶液体积变化忽略不计),计算m的值.(要求有计算过程,只写结果不给分)分析 设加入铁粉的物质的量为x,反应前溶液中
n(Fe3+)=0.1L×1mol/L=0.1mol
溶液中对应的反应关系为
Fe+2FeCl3 =3FeCl2
1mol 2mol 3mol
x 2x 3x
反应后溶液中n(Fe3+)=0.1mol-2x n(Fe2+)=3x
反应前后溶液体积不变,二者的浓度之比就是物质的量之比
$\frac{3x}{0.1mol-2x}$=$\frac{2}{1}$,由此分析解答.
解答 解:设加入铁粉的物质的量为x,反应前溶液中
n(Fe3+)=0.1L×1mol/L=0.1mol
溶液中对应的反应关系为
Fe+2FeCl3 =3FeCl2
1mol 2mol 3mol
x 2x 3x
反应后溶液中n(Fe3+)=0.1mol-2x n(Fe2+)=3x
反应前后溶液体积不变,二者的浓度之比就是物质的量之比
$\frac{3x}{0.1mol-2x}$=$\frac{2}{1}$,解之得:x=$\frac{0.2}{7}$mol
m$\frac{0.2}{7}$mol×56g/mol=1.6g
答:加入铁粉的质量(或m的值)为1.6g.
点评 本题考查混合物的计算,解答本题的关键时正确结合反应的离子方程式计算该题,比较容易.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
9.在一定条件下,2N02?N204正反应放热,达到平衡,下列说法正确的是( )
| A. | 在密闭定容体系中降温,混合气颜色变浅,体系压强增大 | |
| B. | 只降温,混合气体颜色变浅,说明正反应是放热的 | |
| C. | 加压时,混合气颜色开始变浅,后来又逐渐加深 | |
| D. | 加压时,混合气颜色开始变深,后来又逐渐变浅 |
10.想下列溶液中,各组离子一定能够大量共存的是( )
| A. | 能使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe2+ | |
| B. | 能使紫色石蕊试液变红的溶液:Fe2+、Mg2+、MnO4-、Cl- | |
| C. | 常温pH<7的溶液K+、Ba2+、Cl-、Br- | |
| D. | 碳酸氢钠溶液K+、SO42-、Cl-、H+ |
7.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,32gO2和O3的混合气体所含原子数为2NA | |
| B. | 0.5mol/L MgCl2溶液中,含有Cl-离子数为NA | |
| C. | 2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 标准状况下,22.4L H2O含有氢原子数为2NA |
4.研究电化学腐蚀及防护的装置如图所示,下列有关说法正确的是( )
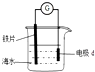

| A. | d为锌块,铁片腐蚀加快 | |
| B. | d为石墨,铁片不易被腐蚀 | |
| C. | d为锌块,铁片上电极反应为:2H++2e-=H2↑ | |
| D. | d为石墨,石墨上电极反应为:O2+2H2O+4e-=4OH- |
11.关于有机物的下列说法中,正确的是( )
| A. | 所有醇和卤代烃都能发生消去反应 | |
| B. | 甲苯能使溴水因化学反应褪色而苯不能 | |
| C. | 苯酚在70℃水中溶解度不大 | |
| D. | 低级酯的密度一般小于水 |