题目内容
3.某同学需要0.40mol/L的CuSO4溶液240mL,用胆矾晶体(CuSO4•5H2O)来配制.请回答下列问题:(1)现有配制过程中所需仪器:托盘天平、药匙、烧杯、量筒、胶头滴管,还需用到的玻璃仪器的名称是250mL容量瓶、玻璃棒.
(2)请写出该实验的简要的实验步骤:
①计算 ②称量胆矾25.0g ③溶解 ④转移⑤洗涤并转移⑥定容⑦摇匀
(3)简述操作⑥的具体过程:向容量瓶中加水至离刻度线1-2cm处,改用胶头滴管加水至溶液凹液面与刻度线相切.
(4)该同学在定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度.对所配溶液浓度的影响是偏低(填“偏高”、“偏低”或“无影响”).
分析 (1)溶液配制的一般操作步骤有:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,根据配制溶液的实验操作过程选择所需的仪器;
(2)根据溶液配制的一般操作步骤分析;实验室没有240mL容量瓶,选择250mL容量瓶.利用n=cv计算出硫酸铜的物质的量,根据铜离子守恒可知硫酸铜与硫酸铜晶体的物质的量相等,再根据m=nM计算所需硫酸铜晶体的质量;
(3)操作⑥为定容,离刻度线1-2cm处用胶头滴管,注意胶头滴管不能伸入容量瓶中;
(4)根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断.
解答 解:(1)实验室没有240mL容量瓶,选择250mL容量瓶.溶液配制一般步骤是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀,
所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,
故还需要的玻璃仪器有:250mL容量瓶、玻璃棒,
故答案为:250mL容量瓶、玻璃棒;
(2)实验室没有240mL容量瓶,选择250mL容量瓶.需硫酸铜晶体的质量为m=0.25L×0.40mol•L-1×250g/mol=25.0g,溶液配制的一般操作步骤有:计算、称量、溶解、转移、洗涤移液、定容、摇匀等操作,所以③为溶解,
故答案为:25.0;溶解;
(3)操作⑥为定容,先直接向容量瓶中加水,待水至离刻度线1-2cm处,改用胶头滴管加水至溶液凹液面与刻度线相切,
故答案为:向容量瓶中加水至离刻度线1-2cm处,改用胶头滴管加水至溶液凹液面与刻度线相切;
(4)定容后把容量瓶倒置摇匀,发现液面低于刻度线又加水至刻度线,是因为一部分溶液留在瓶塞与瓶口之间,又滴加蒸馏水至刻度,导致稀溶液体积偏大,则浓度偏低,
故答案为:偏低.
点评 本题考查了配制一定物质的量浓度的溶液的方法,题目难度不大,明确配制步骤为解答关键,注意掌握配制过程中误差分析的方法与技巧,试题有利于培养学生的化学实验能力.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案 则下列预测正确的是( )
则下列预测正确的是( )| A. | 该单质很难与其他物质发生反应 | B. | 其最高价氧化物的化学式为XO3 | ||
| C. | 第三层的电子数为8个 | D. | 元素X是一种非金属元素 |
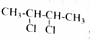 为原料制备某五元环化合物的流程如图所示:
为原料制备某五元环化合物的流程如图所示: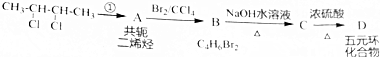
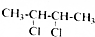 的系统命名为2,3-二氯丁烷.
的系统命名为2,3-二氯丁烷.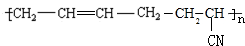 等.
等.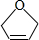 .
.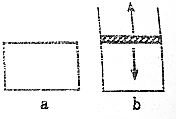 已知2N02?N2O4△H<0.将N02充入容易导热的材料制成的容器a和b中进行反应,a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等.当同温同压时,将等量的NO2充入“起始态”体积相同的容器a、b中,反应同时开始.
已知2N02?N2O4△H<0.将N02充入容易导热的材料制成的容器a和b中进行反应,a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等.当同温同压时,将等量的NO2充入“起始态”体积相同的容器a、b中,反应同时开始.
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: .
.