题目内容
4.研究电化学腐蚀及防护的装置如图所示,下列有关说法正确的是( )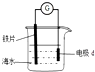
| A. | d为锌块,铁片腐蚀加快 | |
| B. | d为石墨,铁片不易被腐蚀 | |
| C. | d为锌块,铁片上电极反应为:2H++2e-=H2↑ | |
| D. | d为石墨,石墨上电极反应为:O2+2H2O+4e-=4OH- |
分析 A、锌比铁片活泼,所以金属锌是负极;
B、d为石墨,铁片活泼,金属铁是负极;
C、d为锌块,作为负极,因海水呈中性,所以发生吸氧腐蚀;
D、海水呈中性,所以发生吸氧腐蚀.
解答 解:A、锌比铁片活泼,所以腐蚀锌,所以铁片不易被腐蚀,故A正确;
B、d为石墨,活泼金属铁片作负极,发生腐蚀,所以铁片腐蚀加快,故B错误;
C、d为锌块,作为负极,因海水呈中性,所以发生吸氧腐蚀,所以铁片上电极反应为:O2+2H2O+4e-═4OH-,故C错误;
D、海水呈中性,所以发生吸氧腐蚀,所以石墨作正极,电极反应:O2+2H2O+4e-═4OH-,故D正确;
故选D.
点评 本题考查了原电池原理,根据电极上得失电子判断正负极,再结合电极反应类型、电子流向来分析解答,熟记原电池原理,难点是电极反应式的书写.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.下列各组物质中,化学键类型完全相同的是( )
| A. | HI和NaI | B. | H2S和CO2 | C. | H2O2和CCl4 | D. | Na2O2和NaBr |
12.关于一些重要化学概念的说法:①氢氧化钠的摩尔质量为40g/mol;②用酒精做萃取剂,提取碘水中的碘;③酸雨是指pH小于5.6的降水;④氧化还原反应的本质是反应前后元素的化合价变化;⑤丁达尔效应可以区分溶液和胶体;其中正确的是( )
| A. | ①②③ | B. | ②③⑤ | C. | ③④⑤ | D. | ①③⑤ |
13.已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,要使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$比值增大,可以采用的措施是( )
| A. | 加少量CH3COONH4固体 | B. | 加浓醋酸 | ||
| C. | 加少量NaCl固体 | D. | 升高温度 |





 实验小组的同学探究铁与浓、稀硝酸反应的还原产物.他们通过查资料得知:Nessler试剂(K2HgI4的KOH溶液)可与NH4+反应生成沉淀
实验小组的同学探究铁与浓、稀硝酸反应的还原产物.他们通过查资料得知:Nessler试剂(K2HgI4的KOH溶液)可与NH4+反应生成沉淀