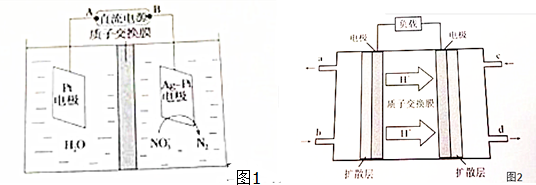
题目内容
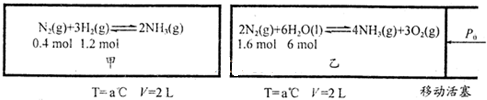
对工业合成氨条件的探索一直是化学工业的重要课题,在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应,如图1(图中所示数据均为初始物理量).t分钟后反应均达到平衡,生成NH3均为0.4mol(忽略水对压强的影响及氨气的溶解).
①判断甲容器中的反应达平衡的依据是 .(填写相应编号)
A.压强不随时间改变
B.气体的密度不随时间改变
C.c(N2)不随时间改变
D.单位时间内生成2molNH3的同时消耗1molN2
E.单位时间内断裂3mol H-H键,同时断裂6mol N-H键
②该条件下甲容器中反应的平衡常数K= ;平衡时,甲的压强P平= (初始压强用P0表示).
③该条件下,若向乙中继续加入0.2mol N2,达到平衡时N2转化率= .
①判断甲容器中的反应达平衡的依据是

A.压强不随时间改变
B.气体的密度不随时间改变
C.c(N2)不随时间改变
D.单位时间内生成2molNH3的同时消耗1molN2
E.单位时间内断裂3mol H-H键,同时断裂6mol N-H键
②该条件下甲容器中反应的平衡常数K=
③该条件下,若向乙中继续加入0.2mol N2,达到平衡时N2转化率=
考点:化学平衡的计算
专题:化学平衡专题
分析:①根据化学平衡状态的特征来确定化学平衡状态;
②平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,化学平衡常数只与温度有关;根据“三段式”来进行计算得出结论;在恒温恒容的容器中压强之比等于气体的物质的量比;
③根据温度不变化学平衡常数不变结合“三段式”计算得出达到平衡时N2转换率.
②平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,化学平衡常数只与温度有关;根据“三段式”来进行计算得出结论;在恒温恒容的容器中压强之比等于气体的物质的量比;
③根据温度不变化学平衡常数不变结合“三段式”计算得出达到平衡时N2转换率.
解答:
解:①A.反应前后气体的系数和不相等,当压强不随时间改变的状态是平衡状态,故A正确;
B.气体的密度等于混合气体质量和体系体积的比值,体系质量和体积均不变,所以密度不变的状态不一定是平衡状态,故B错误;
C.c(N2)不随时间改变,是化学平衡状态的特征,故C正确;
D.单位时间内生成2molNH3的同时消耗1molN2,不能证明正逆反应速率是相等的,故D错误;
E.单位时间内断裂3molH-H键,同时断裂6molN-H键,能证明正逆反应速率是相等的,故E正确;
故选ACE;
②根据题意:甲容器N2(g)+3H2(g)?2NH3(g),
初始物质的量:0.4mol 1.2mol 0
变化物质的量:0.2mol 0.6mol 0.4mol
平衡物质的量:0.2mol 0.6mol 0.4mol
体积为2L,则C(N2)=0.1mol/L,C(H2)=0.3mol/L,C(NH3)=0.2mol/L,平衡常数为K=
=
=
,初始气体总物质的量=0.4mol+1.2mol=1.6mol,平衡时气体总物质的量:0.2mol+0.6mol+0.4mol=1.2mol,在恒温恒容的容器中压强之比等于气体的物质的量比;甲的压强P平=
P0=
P0,
故答案为:
;
P0;
③化学平衡常数只与温度有关,乙为恒温恒压,根据题意:乙容器2N2(g)+6H2O(l)?4NH3(g)+3O2(g),
初始物质的量:1.6mol 6mol 0 0
变化物质的量:0.2mol 0.6mol 0.4mol 0.3mol
平衡物质的量:1.4mol 5.4mol 0.4mol 0.3mol
体积为2L,则C(N2)=0.7mol/L,C(H2O)=2.7mol/L,C(NH3)=0.2mol/L,C(O2)=0.15mol/L,平衡常数为K=
=
,若向乙中继续加入0.2mol N2,再充入氮气是等容等效过程,转化率就是原来的转化率则X=
×100%=12.5%,
故答案为:12.5%.
B.气体的密度等于混合气体质量和体系体积的比值,体系质量和体积均不变,所以密度不变的状态不一定是平衡状态,故B错误;
C.c(N2)不随时间改变,是化学平衡状态的特征,故C正确;
D.单位时间内生成2molNH3的同时消耗1molN2,不能证明正逆反应速率是相等的,故D错误;
E.单位时间内断裂3molH-H键,同时断裂6molN-H键,能证明正逆反应速率是相等的,故E正确;
故选ACE;
②根据题意:甲容器N2(g)+3H2(g)?2NH3(g),
初始物质的量:0.4mol 1.2mol 0
变化物质的量:0.2mol 0.6mol 0.4mol
平衡物质的量:0.2mol 0.6mol 0.4mol
体积为2L,则C(N2)=0.1mol/L,C(H2)=0.3mol/L,C(NH3)=0.2mol/L,平衡常数为K=
| c2(NH3) |
| c(N2)?c3(H2) |
| 0.22 |
| 0.1×0.33 |
| 400 |
| 27 |
| 1.2 |
| 1.6 |
| 3 |
| 4 |
故答案为:
| 400 |
| 27 |
| 3 |
| 4 |
③化学平衡常数只与温度有关,乙为恒温恒压,根据题意:乙容器2N2(g)+6H2O(l)?4NH3(g)+3O2(g),
初始物质的量:1.6mol 6mol 0 0
变化物质的量:0.2mol 0.6mol 0.4mol 0.3mol
平衡物质的量:1.4mol 5.4mol 0.4mol 0.3mol
体积为2L,则C(N2)=0.7mol/L,C(H2O)=2.7mol/L,C(NH3)=0.2mol/L,C(O2)=0.15mol/L,平衡常数为K=
| c3(O2)×c4(NH3) |
| c2(N2)×c6(H2O) |
| 0.33×0.44 |
| 1.42×5.46 |
| 0.2 |
| 1.6 |
故答案为:12.5%.
点评:本题考查较综合,涉及化学平衡及化学平衡的计算等,掌握平衡常数的应用是解答该题的关键,题目难度中等.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
能正确表示下列反应的离子方程式是( )
A、用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH3)
| ||||||
B、向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-
| ||||||
| C、向苯酚钠溶液中通入少量的CO2:CO2+H2O+2C6H5O-→ 2C6H5OH+2CO32- | ||||||
| D、甘氨酸(H2N-CH2-COOH)与氢氧化钠溶液反应:H2N-CH2-COOH+OH-→H2N-CH2COO-+H2O |
锎是一种放射性元素,该元素的一种核素在医学上常用作治疗恶性肿瘤的中子源.下列说法正确的是( )
A、
| ||||
B、
| ||||
C、
| ||||
| D、锎元素的相对原子质量为252 |
如图为周期表前四周期的一部分,关于X、Y、Z、M的说法正确的是( )
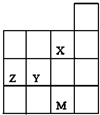

| A、Y、Z的最高价氧化物的水化物酸性为Y<Z |
| B、M的最外层电子数比Z大10 |
| C、X、M的气态氢化物的稳定性M>X |
| D、X、Y形成简单离子的最外层电子均满足8e-稳定结构 |
在一支50mL酸式滴定管中盛入0.1mol/L HCl溶液,其液面恰好在20mL刻度处.若把滴定管中的溶液全部放入锥形瓶中,滴人3滴酚酞试液,然后以0.1mol/L NaOH溶液进行滴定,当溶液刚好变为浅红色时,消耗NaOH镕液的体积( )
| A、等于20mL |
| B、小于20mL |
| C、等于30mL |
| D、大于30ml. |
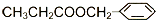 )在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其他两种有机物的路线如下:
)在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其他两种有机物的路线如下: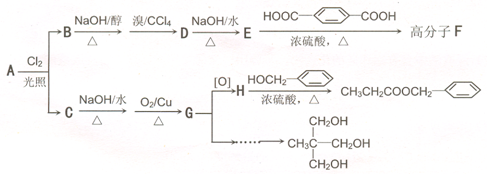

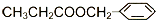 互为同分异构体的是:
互为同分异构体的是: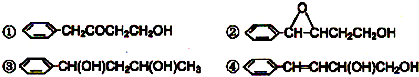
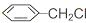 直接合成该香精,化学方程式为
直接合成该香精,化学方程式为 ,写出合成路线(注明条件,不要求写化学方程式)
,写出合成路线(注明条件,不要求写化学方程式)