题目内容
短周期主族元素A、B、C、D,原子半径依次减小,其中A的单质是一种重要的半导体材料;B的单质常用于自来水消毒;C是金属,其密度是所有金属中最小;D的一种气态氢化物能使湿润的红色石蕊试纸变蓝.则下列说法错误的是( )
| A、D的气态氢化物比A的气态氢化物稳定 |
| B、A的常见氧化物是一种酸性氧化物,能与水反应生成一种弱酸 |
| C、B的最高价氧化物对应的水化物是酸性最强的含氧酸 |
| D、单质C常温下能与水反应生成一种气体 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:短周期主族元素A、B、C、D,原子半径依次减小,其中A的单质是一种重要的半导体材料,则A是Si元素;B的单质常用于自来水消毒,则B是Cl元素;C是金属,其密度是所有金属中最小,则C是Li元素;D的一种气态氢化物能使湿润的红色石蕊试纸变蓝,则D是N元素,结合物质的性质分析解答.
解答:
解:短周期主族元素A、B、C、D,原子半径依次减小,其中A的单质是一种重要的半导体材料,则A是Si元素;B的单质常用于自来水消毒,则B是Cl元素;C是金属,其密度是所有金属中最小,则C是Li元素;D的一种气态氢化物能使湿润的红色石蕊试纸变蓝,则D是N元素,
A.非金属性N>Si,故氢化物稳定性NH3>SiH4,故A正确;
B.A的常见氧化物是二氧化硅,是一种酸性氧化物,不能与水反应生,故B错误;
C.B是Cl元素,酸性最强的含氧酸是HClO4,故C正确;
D.Li常温下能与水反应生成氢氧化锂和氢气,故D正确;
故选:B.
A.非金属性N>Si,故氢化物稳定性NH3>SiH4,故A正确;
B.A的常见氧化物是二氧化硅,是一种酸性氧化物,不能与水反应生,故B错误;
C.B是Cl元素,酸性最强的含氧酸是HClO4,故C正确;
D.Li常温下能与水反应生成氢氧化锂和氢气,故D正确;
故选:B.
点评:本题考查元素推断、物质的性质、元素周期律等,正确推断元素是解本题关键,注意对基础知识的理解掌握.

练习册系列答案
相关题目
化学与生产、生活密切相关.下列说法正确的是( )
| A、光导纤维的主要成分是单质硅 |
| B、新型氢动力汽车的使用可减少雾霾的产生 |
| C、明矾可用于自来水消毒 |
| D、福尔马林可用于食品保鲜 |
能正确表示下列反应的离子方程式是( )
A、用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH3)
| ||||||
B、向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-
| ||||||
| C、向苯酚钠溶液中通入少量的CO2:CO2+H2O+2C6H5O-→ 2C6H5OH+2CO32- | ||||||
| D、甘氨酸(H2N-CH2-COOH)与氢氧化钠溶液反应:H2N-CH2-COOH+OH-→H2N-CH2COO-+H2O |
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kj/molNa202(s)+CO2(g)=Na2C03(s)+
02(g)△H=-226kj/mol 下列表述正确的是(NA代表阿伏伽德罗常数的数值)( )
| 1 |
| 2 |
| A、lmolCO燃烧时放出的热量为283 kJ/mol |
| B、Na2O2和Na2C03中阴阳离子个数比不同 |
| C、Na202(s)与CO2(g)反应放出226kJ热量时电子转移数为2NA |
| D、Na202(s)+CO(g)=Na2C03(s)△H=-509 kJhnol |
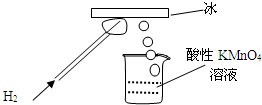 某研究性学习小组做了一个如图所示的实验,在导管口点燃氢气后,发现烧杯中酸性溶液褪色,若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.下列判断正确的是
某研究性学习小组做了一个如图所示的实验,在导管口点燃氢气后,发现烧杯中酸性溶液褪色,若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.下列判断正确的是( )
| A、该条件下H2燃烧放出的热量使冰分解产生了氧气 |
| B、该条件下H2被冷却为液态氢,液氢的水溶液具有氧化性 |
| C、该条件下生成的物质具有氧化性和还原性 |
| D、该条件下生成的水分子化学性质比较活泼 |
锎是一种放射性元素,该元素的一种核素在医学上常用作治疗恶性肿瘤的中子源.下列说法正确的是( )
A、
| ||||
B、
| ||||
C、
| ||||
| D、锎元素的相对原子质量为252 |

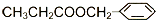 )在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其他两种有机物的路线如下:
)在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其他两种有机物的路线如下: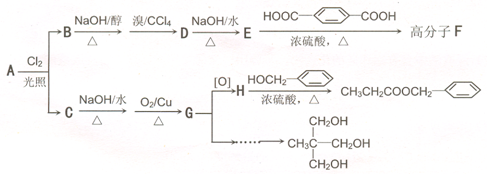

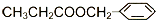 互为同分异构体的是:
互为同分异构体的是: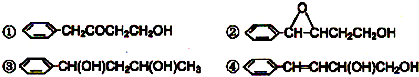
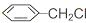 直接合成该香精,化学方程式为
直接合成该香精,化学方程式为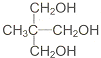 ,写出合成路线(注明条件,不要求写化学方程式)
,写出合成路线(注明条件,不要求写化学方程式)