题目内容
将1.0mol X气体和1.0mol Y气体混合于2L的密闭容器中,发生反应2X(g)+Y(g)?2Z(g)+2W(g),2min末,测得生成了0.4mol W.
(1)前2min以X表示的平均反应速率为 ;
(2)下列叙述能说明该反应已达到化学平衡状态的是 .
A.单位时间里,消耗2mol X,同时生成2mol W
B.单位时间里,消耗2mol X,同时也消耗了2mol Z
C.反应混合物中各物质的浓度相等
D.反应混合物中各物质的浓度不再改变.
(1)前2min以X表示的平均反应速率为
(2)下列叙述能说明该反应已达到化学平衡状态的是
A.单位时间里,消耗2mol X,同时生成2mol W
B.单位时间里,消耗2mol X,同时也消耗了2mol Z
C.反应混合物中各物质的浓度相等
D.反应混合物中各物质的浓度不再改变.
考点:反应速率的定量表示方法,化学平衡状态的判断
专题:化学平衡专题
分析:(1)先计算W的平均反应速率,再根据同一反应中,各物质的反应速率之比等于计量数之比判断X的平均反应速率;
(2)根据平衡状态的标志进行分析;
A.单位时间里,消耗2mol X,同时生成2mol W,都是正反应方向;
B.单位时间里,消耗2mol X,同时也消耗了2mol Z,V(正)=V(逆);
C.反应混合物中各物质的浓度相等,反应并不一定达到平衡;
D.反应混合物中各物质的浓度不再改变,反应达到平衡,这是平衡状态的特征.
(2)根据平衡状态的标志进行分析;
A.单位时间里,消耗2mol X,同时生成2mol W,都是正反应方向;
B.单位时间里,消耗2mol X,同时也消耗了2mol Z,V(正)=V(逆);
C.反应混合物中各物质的浓度相等,反应并不一定达到平衡;
D.反应混合物中各物质的浓度不再改变,反应达到平衡,这是平衡状态的特征.
解答:
解:(1)2X(g)+Y(g)?2Z(g)+2W(g)
反应开始 1.0mol 1.0mol 0 0
2min末 0.6mol 0.8mol 0.4 mol 0.4 mol
所以,前2min以X的浓度表示的平均反应速率v(X)=
=
=0.1mol/L?min,
故答案为:0.1mol/L?min;
(2)A.单位时间里,消耗2mol X,同时生成2mol W,都是正反应方向,故A错误;
B.单位时间里,消耗2mol X,同时也消耗了2mol Z,V(正)=V(逆),故B正确;
C.反应混合物中各物质的浓度相等,反应并不一定达到平衡,故C错误;
D.反应混合物中各物质的浓度不再改变,反应达到平衡,这是平衡状态的特征,故D正确;
故答案为:BD.
反应开始 1.0mol 1.0mol 0 0
2min末 0.6mol 0.8mol 0.4 mol 0.4 mol
所以,前2min以X的浓度表示的平均反应速率v(X)=
| △n |
| V△t |
| 0.4mol |
| 2L?2min |
故答案为:0.1mol/L?min;
(2)A.单位时间里,消耗2mol X,同时生成2mol W,都是正反应方向,故A错误;
B.单位时间里,消耗2mol X,同时也消耗了2mol Z,V(正)=V(逆),故B正确;
C.反应混合物中各物质的浓度相等,反应并不一定达到平衡,故C错误;
D.反应混合物中各物质的浓度不再改变,反应达到平衡,这是平衡状态的特征,故D正确;
故答案为:BD.
点评:本题考查的是反应速率的定量表示方法,解题时注意:反应速率是平均值不是即时值,是浓度的变化量与时间的比值,不是浓度与时间的比值.

练习册系列答案
相关题目
化学与生产、生活密切相关.下列说法正确的是( )
| A、光导纤维的主要成分是单质硅 |
| B、新型氢动力汽车的使用可减少雾霾的产生 |
| C、明矾可用于自来水消毒 |
| D、福尔马林可用于食品保鲜 |
下列说法中错误的是( )
| A、熔融状态下能够导电的化合物中一定存在离子键 |
| B、单原子形成的离子,一定与稀有气体原子的核外电子排布相同 |
| C、L层上的电子数为奇数的原子一定是主族元素的原子 |
| D、同一主族的元素的原子,最外层电子数相同,化学性质不一定完全相同 |
某醇的分子式为CnH2n+1OH,该醇2.3g与足量的金属钠反应,生成氢气0.56L(标准状况),则此醇的相对分子质量是( )
| A、92 | B、69 | C、46 | D、32 |
NA代表阿伏加德罗常数.下列有关NA的叙述中,正确的是( )
| A、1mol任何物质所含的分子数均为NA |
| B、14g氮气所含的氮原子数为NA |
| C、标准状况下,22.4L水所含的水分子数为NA |
| D、在钠与氯气的反应中,1mol钠失去电子的数目为2NA |
能正确表示下列反应的离子方程式是( )
A、用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH3)
| ||||||
B、向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-
| ||||||
| C、向苯酚钠溶液中通入少量的CO2:CO2+H2O+2C6H5O-→ 2C6H5OH+2CO32- | ||||||
| D、甘氨酸(H2N-CH2-COOH)与氢氧化钠溶液反应:H2N-CH2-COOH+OH-→H2N-CH2COO-+H2O |
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kj/molNa202(s)+CO2(g)=Na2C03(s)+
02(g)△H=-226kj/mol 下列表述正确的是(NA代表阿伏伽德罗常数的数值)( )
| 1 |
| 2 |
| A、lmolCO燃烧时放出的热量为283 kJ/mol |
| B、Na2O2和Na2C03中阴阳离子个数比不同 |
| C、Na202(s)与CO2(g)反应放出226kJ热量时电子转移数为2NA |
| D、Na202(s)+CO(g)=Na2C03(s)△H=-509 kJhnol |
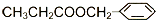 )在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其他两种有机物的路线如下:
)在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其他两种有机物的路线如下: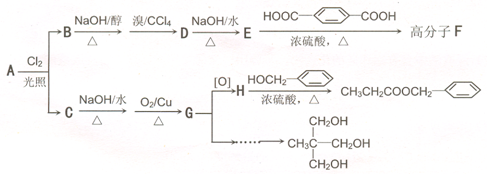

 互为同分异构体的是:
互为同分异构体的是: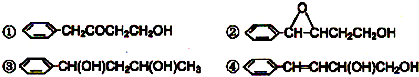
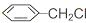 直接合成该香精,化学方程式为
直接合成该香精,化学方程式为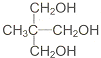 ,写出合成路线(注明条件,不要求写化学方程式)
,写出合成路线(注明条件,不要求写化学方程式)