题目内容
下列物质的化学用语正确的是( )
①NH4H的电子式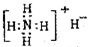
②硝基苯的结构简式:
③葡萄糖的实验式:CH2O
④甲烷分子的比例模型:
⑤Fe2+的离子结构:
⑥原子核内有10个中子的氧原子:
O.
①NH4H的电子式
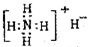
②硝基苯的结构简式:

③葡萄糖的实验式:CH2O
④甲烷分子的比例模型:

⑤Fe2+的离子结构:

⑥原子核内有10个中子的氧原子:
18 8 |
| A、②③⑥ | B、①③⑤⑥ |
| C、③⑥ | D、①②③④⑤⑥ |
考点:电子式,原子结构示意图,结构简式,球棍模型与比例模型
专题:化学用语专题
分析:①NH4H为离子化合物,铵根离子和氢离子都需要标出原子的最外层电子及所带电荷,且复杂阳离子和阴离子均需要中括号;
②硝基写在苯环的左边时,应该表示为;O2N-,硝基苯正确的结构简式为: ;
;
③葡萄糖的分子式为:C6H12O6,葡萄糖的实验式为:CH2O;
④甲烷分子的比例模型应该体现出甲烷分子中各原子的相对体积大小, 为甲烷的球棍模型,甲烷的比例模型为:
为甲烷的球棍模型,甲烷的比例模型为: ;
;
⑤ 为 Fe2+的离子结构示意图;
为 Fe2+的离子结构示意图;
⑥氧原子的核电荷数为8,原子核内有10个中子的氧原子的质量数为18,该氧原子可以表示为:
O.
②硝基写在苯环的左边时,应该表示为;O2N-,硝基苯正确的结构简式为:
 ;
;③葡萄糖的分子式为:C6H12O6,葡萄糖的实验式为:CH2O;
④甲烷分子的比例模型应该体现出甲烷分子中各原子的相对体积大小,
 为甲烷的球棍模型,甲烷的比例模型为:
为甲烷的球棍模型,甲烷的比例模型为: ;
;⑤
 为 Fe2+的离子结构示意图;
为 Fe2+的离子结构示意图;⑥氧原子的核电荷数为8,原子核内有10个中子的氧原子的质量数为18,该氧原子可以表示为:
18 8 |
解答:
解:①NH4H为离子化合物,铵根离子和氢离子都需要标出原子的最外层电子及所带电荷,且复杂阳离子和阴离子均需要中括号,故错误;
②硝基写在苯环的左边时,应该表示为;O2N-,硝基苯正确的结构简式为: ,故错误;
,故错误;
③葡萄糖的分子式为:C6H12O6,葡萄糖的实验式为:CH2O,故正确;
④甲烷分子的比例模型应该体现出甲烷分子中各原子的相对体积大小, 为甲烷的球棍模型,甲烷的比例模型为:
为甲烷的球棍模型,甲烷的比例模型为: ,故错误;
,故错误;
⑤ 为 Fe2+的离子结构示意图,故错误;
为 Fe2+的离子结构示意图,故错误;
⑥氧原子的核电荷数为8,原子核内有10个中子的氧原子的质量数为18,该氧原子可以表示为:
O,故正确;
故选C.
②硝基写在苯环的左边时,应该表示为;O2N-,硝基苯正确的结构简式为:
 ,故错误;
,故错误;③葡萄糖的分子式为:C6H12O6,葡萄糖的实验式为:CH2O,故正确;
④甲烷分子的比例模型应该体现出甲烷分子中各原子的相对体积大小,
 为甲烷的球棍模型,甲烷的比例模型为:
为甲烷的球棍模型,甲烷的比例模型为: ,故错误;
,故错误;⑤
 为 Fe2+的离子结构示意图,故错误;
为 Fe2+的离子结构示意图,故错误;⑥氧原子的核电荷数为8,原子核内有10个中子的氧原子的质量数为18,该氧原子可以表示为:
18 8 |
故选C.
点评:本题考查了电子式、结构简式、球棍模型与比例模型、元素符号等化学用语的判断,题目难度中等,注意掌握常见化学用语的表示方法,明确球棍模型与比例模型、结构简式与结构式的区别.

练习册系列答案
相关题目
下列化合物中,不能由单质之间直接化合生成的是( )
| A、Na2O |
| B、Na2O2 |
| C、CuCl2 |
| D、FeCl2 |
NA代表阿伏加德罗常数值,下列说法正确的是( )
| A、32gCu与足量的硫蒸汽充分反应,电子转移总数为1.0NA |
| B、1.4g乙烯和丙烯的混合物中含原子数为0.3NA |
| C、常温常压下,11.2L乙烷所含分子数小于0.5NA |
| D、2.24L(标准状况)Cl2与足量NaOH溶液在常温下反应.转移的电子数为0.2NA |
下列反应的离子方程式错误的是( )
| A、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
B、向苯酚钠溶液中通入CO2: +CO2+H2O→ +CO2+H2O→ +HCO3- +HCO3- |
| C、小苏打溶液中加入少量石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
| D、NaHS水解反应:HS-+H2O?S2-+H3O+ |
 工业合成氨时将N2和H2按体积比为1:3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:
工业合成氨时将N2和H2按体积比为1:3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:
 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式